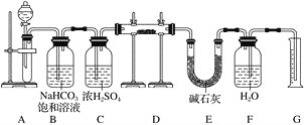
-
用4×10-3 mol的KZO4 恰好将60 mL 0.1 mol/L的Na2SO3溶液氧化为Na2SO4,则元素Z在还原产物中的化合价是
A. +6 B. +4 C. +3 D. +2
难度: 中等查看答案及解析
-
在反应H2S+H2SO4(浓)=S↓+SO2↑+2H2O中,若有32g硫生成则转移电子为( )
A.6 mol B.2 mol C.3 mol D.4 mol
难度: 中等查看答案及解析
-
根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
A.Br->I->Fe2+ B.I->Fe2+>Br-
C.Fe2+>I->Br- D.Br->Fe2+>I-
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.碳酸氢钙溶液与盐酸混合:HCO3—+H+=H2O+CO2↑
B.氢氧化铜中加入盐酸:H++OH-=H2O
C.氯化铁溶液中加入氢氧化钠溶液:Fe2++2OH-=Fe(OH)2↓
D.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
难度: 简单查看答案及解析
-
在下列反应中,HCl作还原剂的是( )
A.NaOH +HCl=NaCl +H2O
B.Zn +2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
D.CuO +2HCl=CuCl2+H2O
难度: 简单查看答案及解析
-
在 FeCl3 和 CuCl2 的混合溶液中加入铁屑,反应结束后滤出固体物质,滤液中的阳离子可能是
①只有Fe2+ ②Fe2+和Fe3+ ③Fe2+和Cu2+ ④Cu2+和Fe3+
A. ①③ B. ②④ C. ①④ D. ②③
难度: 中等查看答案及解析
-
下列物质能通过化合反应直接制得的是
①FeCl2②FeCl3③Fe(OH)3④HCl
A.只有①②③ B.只有②③ C.只有①③④ D.全部
难度: 中等查看答案及解析
-
将一小块钠投入盛5 mLFeCl2的试管里,不可能观察到的现象是
A.钠熔成小球并在液面上游动
B.有无色无味的气体生成
C.溶液底部有银白色物质生成
D.溶液中产生的沉淀最终为红褐色
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.氯化铝溶液中加入过量氨水:A13++4NH3·H2O═4NH4++2H2O+A1O2﹣
B.FeBr2溶液中通入足量的氯气:2Fe2++2Br﹣+2C12═2Fe3++Br2+4C1﹣
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水Fe2++2H++H2O2═Fe3++2H2O
D.在通入过量SO2后的NaOH溶液中加足量的溴水(不考虑SO2的溶解):HSO3﹣+Br2+H2O═3H++2Br﹣+SO42﹣
难度: 中等查看答案及解析
-
向100mL 0.1mol/L AlCl3溶液中,加入c mol/L NaOH 溶液100mL后,再滴加1mol/L 盐酸,滴加盐酸的体积与生成沉淀的质量关系如图所示,则加入的NaOH溶液的浓度为( )
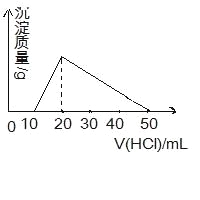
A.0.25mol/L B.2mol/L C.1mol/L D.0.5 mol/L
难度: 困难查看答案及解析
-
相同物质的量的下列物质分别与等物质的量浓度的NaOH溶液反应,至体系中均无固体物质,则消耗NaOH的量最多的是
A.Al B.Al2O3 C.Al(OH)3 D.AlCl3
难度: 简单查看答案及解析
-
下列有关NH4Fe(SO4)2水溶液的叙述正确的是( )
A.该溶液中,H+、Mg2+、NO3﹣、Cl﹣可以大量共存
B.该溶液能使淀粉碘化钾试纸变蓝,反应的离子方程式为:Fe3++2I﹣═Fe2++I2
C.该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42﹣+Ba2++3OH﹣═Fe(OH)3↓+BaSO4↓
D.该溶液与足量铜粉反应的离子方程式为:3Cu+2Fe3+═2Fe+3Cu2+
难度: 中等查看答案及解析
-
相同质量的镁和铝分别与足量的盐酸反应,生成的氢气在相同条件下的体积比是( )
A. 1∶1 B. 1∶2 C. 2∶3 D. 3∶4
难度: 中等查看答案及解析
-
甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A. 2.7g B. 3.6g C. 5.04g D. 4.05g
难度: 中等查看答案及解析
-
向一定量的Fe、Fe2O3、FeO的混合物中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全反应溶解,放出4.48 mL(标准状况)气体。所得溶液中,加入KSCN溶液无红色出现,那么用足量的CO在高温下还原相同质量的此混合物,得到铁的质量为
A.11.2 g B.5.6 g C.2.8 g D.无法计算
难度: 中等查看答案及解析
-
下列说法错误的是
A.Na2O2可用作供氧剂
B.Al2O3可用作耐火材料
C.地沟油经处理后可用作燃料油
D.胶体和溶液的本质区别是胶体具有丁达尔现象
难度: 中等查看答案及解析