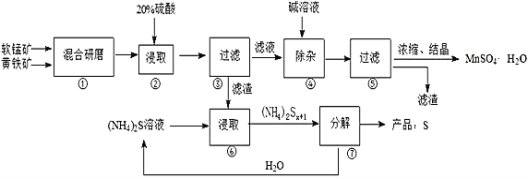
-
《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是
A. “薪柴之灰”可与铵态氮肥混合施用 B. “以灰淋汁”的操作是萃取
C. “取碱”得到的是一种碱溶液 D. “浣衣”过程有化学变化
难度: 中等查看答案及解析
-
南宋著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载;“银针验毒”的原理为4Ag +2H2S + O2 = 2X +2H2O。下列说法正确的是( )
A.X的化学式为AgS B.银针验毒时,O2失去电子
C.反应中Ag和H2S均发生氧化反应 D.每生成1个X,反应转移2e-
难度: 困难查看答案及解析
-
在体积相同的两个密闭容器中分别充入O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的氧原子数目相等 B.两种气体的压强相等
C.两种气体的分子数目相等 D.O2比O3的质量小
难度: 中等查看答案及解析
-
下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂 B.铁粉作食品袋内的脱氧剂
C.漂粉精作消毒剂 D.甘油作护肤保湿剂
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的溶胶能产生丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 中等查看答案及解析
-
反应NH4Cl+NaNO2
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:
B. N2的结构式:N=N
C. Na+的结构示意图:
D. H2O的电子式:
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法错误的是( )
A.3 g 3He含有的中子数为1NA
B.1 L 0.1 mol·L−1磷酸钠溶液含有的
数目为0.1NA
C.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D.常温下,11g CO2所含的共用电子对数目为NA
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L−1NaOH溶液:Na+、K+、
、
B. 0.1 mol·L−1FeCl2溶液:K+、Mg2+、
、
C. 0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D. 0.1 mol·L−1H2SO4溶液:K+、
、
、
难度: 中等查看答案及解析
-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池工作时,光能转化成电能
B. 锂离子电池放电时,化学能转化成电能
C. 电解质溶液导电时,电能转化成化学能
D. 葡萄糖为人类生命活动提供能量时,化学能转化成热能
难度: 中等查看答案及解析
-
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A
B
C
D

NaCl溶于水
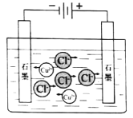
电解CuCl2溶液
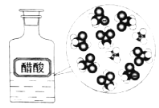
CH3COOH在水中电离
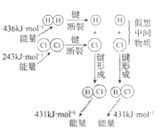 H2与Cl2反应能量变化
H2与Cl2反应能量变化NaCl
Na++Cl−
CuCl2
Cu2++2Cl−
CH3COOH
CH3COO−+H+
H2(g)+Cl2(g)
2HCl(g)
ΔH=−183kJ·mol−1
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
难度: 中等查看答案及解析
-
下列现象或应用与胶体性质无关的是
A.将盐卤或石膏加入豆浆中,制成豆腐
B.冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C.泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用
D.用半透明可以除去淀粉溶液中的少量NaCl
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.NaHCO3溶液与NaOH溶液反应:H++OH−=H2O
B.少量二氧化碳通入足量的NaOH溶液中:CO2+OH−=HCO3-
C.Fe与盐酸反应产生H2:2Fe+6H+=2Fe3++3H2↑
D.氨水和醋酸溶液混合:NH3·H2O+CH3COOH===NH4++CH3COO−+H2O
难度: 中等查看答案及解析
-
已知下列反应:Co2O3+6HCl(浓)=2CoCl2+Cl2↑+3H2O (Ⅰ);5Cl2+I2+6H2O=10HCl+2HIO3 (Ⅱ)。下列说法正确的是( )
A.反应(Ⅰ)中HCl是氧化剂 B.反应(Ⅱ)中Cl2发生氧化反应
C.还原性:CoCl2>HCl>I2 D.氧化性:Co2O3>Cl2>HIO3
难度: 中等查看答案及解析
-
下列离子方程式能用来解释相应实验现象的是( )
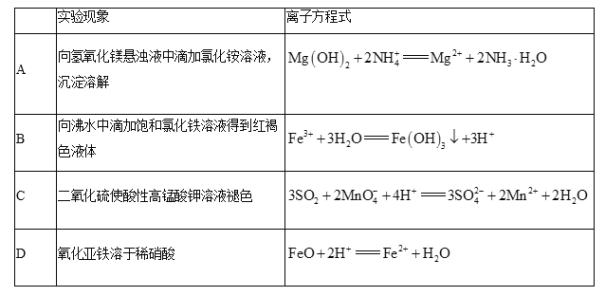
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的是( )
A.
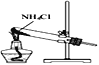
B.
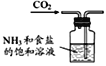
C.
D.
难度: 困难查看答案及解析