-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 中等查看答案及解析
-
准确量取25.00mL的高锰酸钾溶液,可选用仪器( )
A.50mL量筒 B.10mL移液管
C.50mL酸式滴定管 D.50mL碱式滴定管
难度: 简单查看答案及解析
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A. 反应混合物的浓度 B. 反应体系的压强
C. 正、逆反应的速率 D. 反应物的转化率
难度: 简单查看答案及解析
-
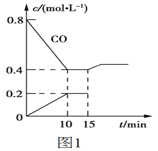
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列说法正确的是
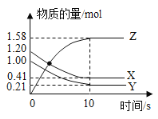
A.反应开始到10s,用Z表示的反应速率为
B.反应开始到10s,X的物质的量浓度减少了
C.反应开始到10s时,Y的转化率为
D.反应的化学方程式为:
难度: 中等查看答案及解析
-
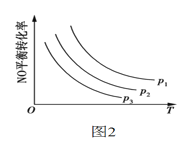
已知某可逆反应m A(g)+n B(g)
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
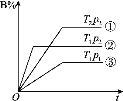
A.T1<T2 p1>p2 m+n>p 放热反应 B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应 D.T1>T2 p1<p2 m+n<p 吸热反应
难度: 简单查看答案及解析
-
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中
和
代表不同元素的原子,
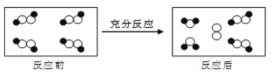
关于此反应说法错误的是( )
A. 一定属于吸热反应 B. 一定属于可逆反应
C. 一定属于氧化还原反应 D. 一定属于分解反应
难度: 中等查看答案及解析
-
为探究外界条件对反应:mA(g)+nB(g)
cZ(g)ΔH的影响,以A和B的物质的量之比为m:n开始反应,通过实验得到不同条件下反应达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )

A.ΔH>0
B.m+n<c
C.升高温度,正、逆反应速率都增大,平衡常数减小
D.恒温恒压时,向已达平衡的体系中加入少量Z(g),再次达到平衡后Z的物质的量分数增大
难度: 简单查看答案及解析
-
能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )
A.向水中投入一小块金属钠 B.将水加热煮沸
C.向水中加入氯化铵固体 D.向水中加醋酸钠晶体
难度: 简单查看答案及解析
-
25 ℃时,两种不同浓度的NaOH溶液中,c(H+)分别为1×10-14 mol·L-1和1×10-10 mol·L-1。将这两种溶液等体积混合后,所得溶液中c(H+)是
A. 1×(10-14+10-10) mol·L-1 B.
mol·L-1
C. 2×10-10 mol·L-1 D. 2×10-14 mol·L-1
难度: 中等查看答案及解析
-
醋酸的下列性质中,可以证明它是弱电解质的是( )
大小相同的铁片与pH相同盐酸和醋酸反应,刚开始时醋酸和盐酸产生H2速率相同;②室温时,0.1mol/L醋酸溶液的pH约为3;③10mL1mol/L醋酸恰好与10mL1mol/LNaOH溶液完全反应;④常温下,测得醋酸钠溶液的pH>7;
醋酸溶液的导电性比盐酸溶液的弱;⑥常温下,将pH=1的醋酸和盐酸稀释相同的倍数倍,测得醋酸的pH变化较小。
A.②④⑤⑥ B.②④⑥ C.①②④ D.②⑥
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是( )
A.0.01mol·L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-)
B.
=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=c(10-2-10-12)mol·L-1
C.等物质的量的NH4Cl和NaCl的混合溶液:c(NH4)+c(NH3·H2O)+c(Na+)=2c(Cl-)
D.0.1mol·L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-)
难度: 简单查看答案及解析
-
下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
在较稀FeCl3溶液中,存在如下水解平衡:Fe3++3H2O
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列说法正确的是
A. 水解平衡不移动 B. 水解平衡向逆反应方向移动
C. 溶液中H+浓度增大 D. Fe3+的水解程度增大
难度: 困难查看答案及解析
-
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:Ksp(BaCO3)=5.1×10-9 mol2·L-2;Ksp(BaSO4)=1.1×10-10 mol2·L-2。下列推断正确的是( )
A. 不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B. 抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C. 若误饮[Ba2+]=1.0×10-5 mol·L-1的溶液时,会引起钡离子中毒
D. 可以用0.36 mol·L-1的Na2SO4溶液给钡离子中毒患者洗胃
难度: 困难查看答案及解析
-
海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是
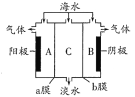
A.b膜是阳离子交换膜
B.A极室产生气泡并伴有少量沉淀生成
C.淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D.B极室产生的气体可使湿润的KI淀粉试纸变蓝
难度: 中等查看答案及解析
-
锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
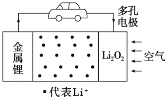
A.电解液中,Li+由多孔电极迁移向锂电极
B.该电池放电时,负极发生了还原反应
C.充电时,电池正极的反应式为Li2O2-2e-=2Li++O2↑
D.电池中的电解液可以是有机电解液或稀盐酸等
难度: 简单查看答案及解析