-
下列有关化学用语或名称表达正确的是
A.Mg的原子结构示意图:
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D.
的名称:2-甲基丁烷
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。上述说法正确的是
A.①③④⑦ B.①②⑤⑥ C.③⑤⑥⑦ D.①②③④
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数,下列说法正确的是
A.反应KClO3+6HCl=KCl+3Cl2↑+ 3H2O中,每生成1molCl2转移的电子为2NA
B.1molC8H18分子中含有的共用电子对数为26NA
C.在0℃,101kPa,1molSO3中含有NA个硫原子
D.0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.在Fe(OH)3胶体中加入HI溶液:Fe(OH)3 +3H+=Fe3+ +3H2O
B.在稀氨水中通入少量SO2:NH3•H2O+SO2=NH4++HSO3-
C.向澄清石灰水中加入足量NaHCO3溶液: Ca2+ +OH-+HCO3-=CaCO3↓+ H2O
D.在酸性KMnO4溶液中加入H2O2: 2MnO4-+5H2O2 +6H+=2Mn2++5O2↑+ 8H2O
难度: 中等查看答案及解析
-
室温下,强酸性和强碱性溶液中都不能共存的离子组是
A.Ba2+、Fe2+、NO3-、I- B.K+、Na+、SO32-、S2-
C.K+、Na+、AlO 2-、SO42- D.NH4+、Cu2+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列顺序不正确的是
A.热稳定性:HF>HCl>HBr>HI
B.微粒的半径:Cl->Na+>Mg2+>Al3+
C.电离程度(同温度同浓度溶液中):HCl>CH3COOH>NaHCO3
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 中等查看答案及解析
-
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊醋的结构简式如图,下列对该化合物叙述正确的是
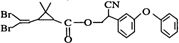
A.属于芳香烃 B.该有机物易溶于水
C.在酸性条件下不水解 D.在一定条件下可以发生加成反应
难度: 中等查看答案及解析
-
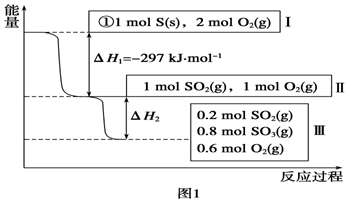
AgCl(s)
Ag+(aq)+Cl-(aq),平衡时,Ksp=C(Ag+ )·C(Cl-) ,过量氯化银分别投入①100 mL水 ②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
A、③①②④ B、④①②③ C、①②③④ D、④③②①
难度: 中等查看答案及解析
-
下列有关实验操作正确的是
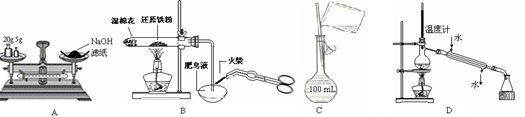
A.称量氢氧化钠固体 B.检验铁粉与水蒸气反应产生的氢气
C.配制150 mL 0.10 mol/L盐酸 D.分离两种互溶但沸点相差较大的液体混合物
难度: 中等查看答案及解析
-
下列判断不正确的是
A.0.1mol/L的NaHA溶液其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
C.pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:c(H+)+c(M+)=c(OH-)+c(A-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
某固体燃料电池以固体氧化铝——氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a.b均不参与电极反应。下列判断不正确的是

A.在电池内部氧离子(O2-)向负极移动
B.b极对应的电极反应式为:C3H8+10O2-—20e-=3CO2+4H2O
C.该电池的总反应方程式为:C3H8+5O2=3CO2+4H2O
D.用该电池做电源电解CuSO4溶液时,每消耗1molC3H8时理论上能得到Cu的最大量为5mol
难度: 中等查看答案及解析
-
图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是
A.b、c、e三种元素的原子半径大小关系:e>c>b
B.六种元素分别形成的单质固体中,d的熔、沸点最高
C.c的氢化物沸点比f的氢化物沸点低
D.b元素除0价外,只有一种化合价
难度: 中等查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
下列说法正确的是
A.若用标准状况下4.48LCH4还原NO2生成N2和水蒸气,放出热量为173.4 kJ/mol
B.由反应①可推知CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H﹥-574kJ/mol
C.反应②中当4.48LCH4反应完全时转移的电子总数为1.60mol
D.反应①②转移的电子数相同
难度: 中等查看答案及解析
-
对P4S3分子的结构研究表明,该分子中不存在不饱和键,且各原子最外层均已达到8个电子稳定结构。则一个P4S3分子中含有的共价键个数为
A.7个 B.9个 C.19个 D.不能确定
难度: 中等查看答案及解析
-
向1mol炽热的Cu2S通人足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
A.Cu和SO2 B.Cu和S C.CuO和SO2 D.Cu2O和S
难度: 中等查看答案及解析