-
化学与生产、生活密切相关。对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
用热的纯碱溶液洗去油污
Na2CO3可直接与油污反应
B
工业上用二氧化硫漂白纸浆
二氧化硫具有强还原性,能将有色物质还原至无色
C
氨用作制冷剂
氨易液化,液氨汽化时吸收大量热,使周围温度降低
D
明矾用作净水剂
明矾能够杀菌消毒
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列说法不正确的是
A.标况下,3.2g N2H4中含有的N-H键的数目为0.4NA
B.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移的电子数为0.1NA
C.2 mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应生成气体的分子数为NA
D.将1 mol Cl2通入足量水中,HClO、Cl-、ClO-的粒子数之和为2NA
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.用石墨作阴极、铜作阳极电解饱和食盐水:2Cl-+2H2O
Cl2↑+H2↑+2OH-
B.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3 ↓+NH3·H2O
C.含0.1 mol FeI2的溶液中滴加含0.1 mol Cl2的氯水:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.酸性KMnO4溶液与双氧水反应:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
难度: 中等查看答案及解析
-
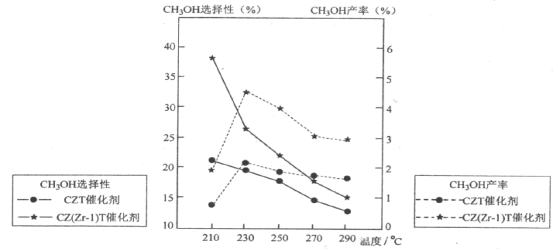
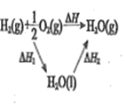
一种新型的合成氨的方法如图所示,下列说法错误的是
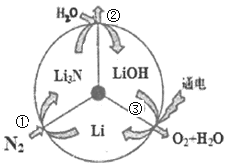
A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
难度: 中等查看答案及解析
-
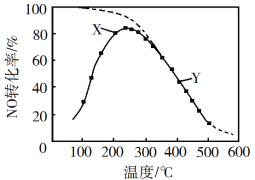
下列实验结果不能作为相应定律或原理的证据之一的是( )
A
B
C
D
勒夏特列原理
元素周期律
盖斯定律
阿伏加德罗定律
实验方案

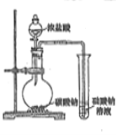
结果
左球气体颜色加深
右球气体颜色变浅
烧瓶中冒气泡
试管中出现浑浊
测得
为
、
的和
与
的体积比约为2:1
(B中试剂为浓盐酸、碳酸钠溶液、硅酸钠溶液)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
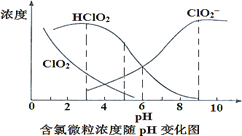
实验室将NaClO3和Na2SO3按物质的量之比1:2倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X和Na2SO4,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
难度: 中等查看答案及解析
-
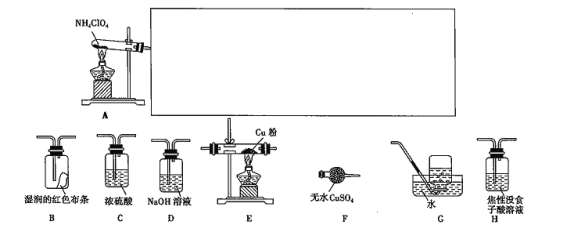
已知FeSO4•7H2O晶体在加热条件下会发生分解反应:2FeSO4•7H2O
Fe2O3+SO2↑+SO3↑+14H2O↑,实验室用如图所示装置检验FeSO4•7H2O的所有分解产物,下列说法不正确的是( )
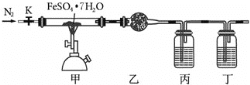
A.实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
B.乙、丙、丁中可依次盛装无水CuSO4、品红溶液、BaCl2溶液
C.还应在丁装置后面连接盛有NaOH溶液的洗气瓶
D.甲中残留固体加稀硫酸溶解,再滴加KSCN溶液,溶液变红
难度: 中等查看答案及解析
-
一定条件下向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,图1表示各物质浓度随时间的变化关系,图2表示速率随时间的变化关系,t2、t3、t4、t5时刻各改变一种条件,且改变的条件均不同。若t4时刻改变的条件是压强,则下列说法错误的是( )
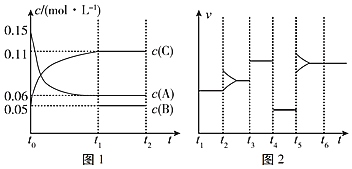
A.若t1=15s,则前15s的平均反应速率υ(C)=0.004mol•L﹣1•s﹣1
B.该反应的化学方程式为3A
B+2C
C.t2、t3、t5时刻改变的条件可能分别是增大反应物浓度、加入催化剂、升高温度
D.若t1=15s,则B的起始物质的量为0.02mol
难度: 中等查看答案及解析
-
室温下,下列说法正确的是( )
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>b>c
B.KNO3溶液和CH3OOONH4溶液pH均为7,但两溶液中水的电离程度相同
C.5.0×10-3 mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)>c(H2A)
D.室温下,欲使0.1mol/L醋酸溶液的pH,电离度都减小,可加入少量水
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
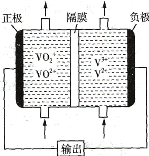
微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
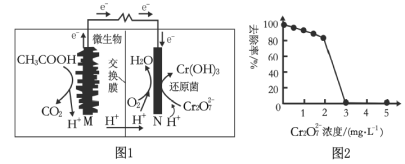
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
难度: 中等查看答案及解析
-
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)
2CO(g) △H=Q kJ/mol。图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是
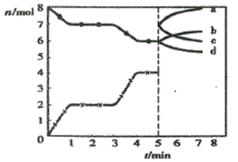
A.0~1min,v(CO)=1 mol/(L·min);1~3min时,v(CO)=v(CO2)
B.当容器内的压强不变时,反应一定达到平衡状态,且
C.3min时温度由T1升高到T2,则Q>0,再达平衡时
D.5min时再充入一定量的CO,a、d曲线分别表示n(CO)、n(CO2)的变化
难度: 中等查看答案及解析
-
某温度下,向25.00mL 0.1 mol·L-1NaOH溶液中滴加0.1 mol·L-1甲酸(HCOOH,弱酸)溶液,所得溶液的pH和pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )
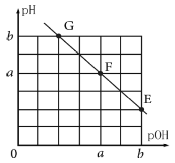
A.F点对应甲酸溶液体积V=25.00 mL
B.F点水的电离程度大于E点水的电离程度
C.温度不变,加水稀释E点溶液,c(HCOOH)/c(HCOO-)增大
D.G点对应溶液c(OH-)=102a-b mol·L-1
难度: 中等查看答案及解析
-
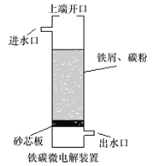
下图是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
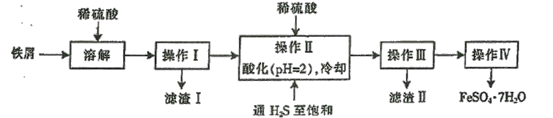
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6,FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。根据以上流程图,下列说法不正确的是
A.操作I所得滤液中不含有Fe3+
B.操作Ⅱ中用硫酸酸化至pH=2的主要目的是抑制Fe2+的水解
C.操作Ⅱ中,通入H2S至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化。
D.操作Ⅳ中所得的晶体最后用乙醇洗去晶体表面附着的水分。
难度: 中等查看答案及解析
-
下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O
2CrO42-(黄色)+ 2H+
序号
a
b
现象
1
2 mL 0.05 mol·L−1 K2Cr2O7溶液(pH = 2)
3滴饱和Na2SO3溶液(pH = 9)
溶液变绿色(含Cr3+)
2
2 mL 0.1 mol·L−1 K2CrO4溶液(pH = 8)
3滴饱和Na2SO3溶液
溶液没有明显变化
3
2 mL饱和Na2SO3溶液
3滴0.05 mol·L−1 K2Cr2O7溶液
溶液变黄色
4
2 mL蒸馏水
3滴0.05 mol·L−1 K2Cr2O7溶液
溶液变成浅橙色
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
难度: 中等查看答案及解析
-
常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )
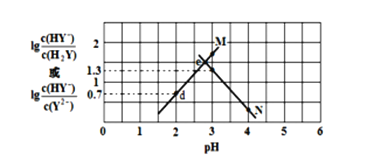
A. 曲线 M 表示 pH与lg
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
难度: 困难查看答案及解析