-
古诗词是中华文化的瑰宝。下列诗词、俗语中涉及了化学反应的是( )
A.只要功夫深,铁杵磨成针
B.千里冰封,万里雪飘
C.野火烧不尽,春风吹又生
D.千淘万漉虽辛苦,吹尽狂沙始到金
难度: 中等查看答案及解析
-
空气中的氧分子在阳光紫外线、闪电等外界因素作用下,会生成氧负离子(O2 - )。O2 -的摩尔质量为( )
A.33 g B.33 g· mol-1 C.32 g D.32 g· mol-1
难度: 中等查看答案及解析
-
常温下,下列分散系中最稳定的是( )
A.泥水 B.豆浆 C. 氢氧化铁胶体 D.氯化钠溶液
难度: 简单查看答案及解析
-
下列关于 1 mol·L-1NaCl 溶液的叙述正确的是( )
A.该溶液中含有 1 mol NaCl
B.1 L 该溶液中含有 58.5 g NaCl
C.该溶液可由 1 mol NaCl 溶于 1 L 水配制而成
D.从 100 mL 该溶液中取出 10 mL 以后,取出溶液的浓度为 0.1 mol·L-1
难度: 中等查看答案及解析
-
在标准状况下,3.4 g NH3 的()
A.分子数约为 6.02×1023 B.物质的量为 0.1 mol
C.体积约为 4.48 L D.氢原子的物质的量为 0.2 mol
难度: 中等查看答案及解析
-
下列生活中的常见操作或现象中不涉及氧化还原反应的是( )
A.家用天然气的燃烧为炒菜提供热量
B.烧菜用过的铁锅经水洗后常出现红棕色锈迹
C.洗涤剂清洗油污
D.饭菜久置后变质腐败
难度: 简单查看答案及解析
-
下列实验操作中,不正确的是( )
A.用托盘天平称取 4.5 g 固体氯化钠 B.在烧杯中稀释浓硫酸
C.用温度计代替玻璃棒搅拌溶液 D.在蒸发皿中蒸发浓缩食盐水
难度: 中等查看答案及解析
-
某溶液中,只含有下表中所示的四种离子(忽略水的电离),则 b 可能为( )
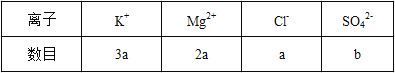
A.2a B.3a C.4a D.5a
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.18 g H2O 中含有的质子数为 10NA
B.0.5 mol·L-1 硫酸中含有的H+数目为 NA
C.1 mol CO 与 0.5 mol O2 反应后的原子数为 3NA
D.H2O2 分解生成 1 mol O2 时转移的电子数为 2NA
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是( )
A.氧化亚铁与稀盐酸混合:FeO+2HCl=Fe2++2Cl-+H2O
B.铜片加入硝酸银溶液中:Cu+2Ag+=2Ag+Cu2+
C.盐酸滴在大理石上:2H++CaCO3=Ca2++H2O+CO2↑
D.铝片加入稀硫酸中:2Al+6H+=2Al3++3H2↑
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 H2SO4 溶液:Na+、Ba2+、NO3- 、Cl-
B.c(H+)=0.1 mol·L-1 的溶液:Mg2+、K+、SO42-、Cl-
C.与 Zn 反应放出 H2 的溶液:H+、K+、NO3- 、CO32-
D.0.1 mol·L-1NaOH 溶液:Ca2+、Na+、SO42- 、HCO3-
难度: 中等查看答案及解析
-
将 Na2CO3 和 Na2S 按 1∶2 的物质的量之比配成溶液,再通入 SO2,可制取 Na2S2O3,同时放出CO2。在该反应中( )
A.被氧化与被还原的原子个数比为 2∶1
B.相同条件下,每吸收 1 m3 SO2 就会放出 2.5 m3 CO2
C.每 1 mol Na2S 反应,则生成的 Na2S2O3 为 1.5 mol
D.若有 106 g Na2CO3 发生反应,反应中转移的电子的物质的量为 4 mol
难度: 中等查看答案及解析

