-
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH-=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
难度: 中等查看答案及解析
-
化学与社会、生产、生活紧切相关。下列说法正确的是
A.石英只能用于生产光导纤维
B.从海水提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
难度: 中等查看答案及解析
-
运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.
和
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
难度: 简单查看答案及解析
-
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2
CO2+H2O。下列有关说法正确的是
A.该反应为吸热反应 B.CO2分子中的化学键为非极性键
C.HCHO分子中既含σ键又含π键 D.每生成1.8g H2O消耗2.24L O2
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列叙述正确的是
A.1.0L 1.0mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA
B.12g石墨烯(单层石墨)中含有六元环的个数0.5NA
C.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1mol的羟基与1mol的氢氧根离子所含电子数均为9NA
难度: 中等查看答案及解析
-
足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是
A.氢氧化钠溶液 B.稀硫酸 C.盐酸 D.稀硝酸
难度: 中等查看答案及解析
-
下列有关实验的做法不正确的是
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配置0.1000 mol•L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A.
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C.
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列实验误差分析错误的是( )
A.用湿润的pH试纸测稀碱液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
难度: 中等查看答案及解析
-
利用实验器材(规格和数量不限),能完成相应实验的一项是
实验器材(省略夹持装置)
相应实验
A
烧杯、玻璃棒、蒸发皿
硫酸铜溶液的浓缩结晶
B
烧杯、玻璃棒、胶头滴管、滤纸
用盐酸除去硫酸钡中的少量碳酸钡
C
烧杯、玻璃棒、胶头滴管、容量瓶
用固体氯化钠配制0.5mol/L的溶液
D
烧杯、玻璃棒、胶头滴管、分液漏斗
用溴水和CCl4除去NaBr溶液中的少量NaI
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
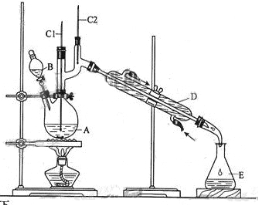
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
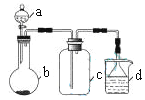
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
难度: 困难查看答案及解析
-
我省盛产矿盐(主要成分是NaCl,还含有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
难度: 简单查看答案及解析
-
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:
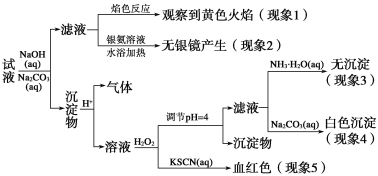
已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是( )。
A.根据现象1可推出该试液中含有Na+
B.根据现象2可推出该试液中并不含有葡萄糖酸根
C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D.根据现象5可推出该试液中一定含有Fe2+
难度: 简单查看答案及解析
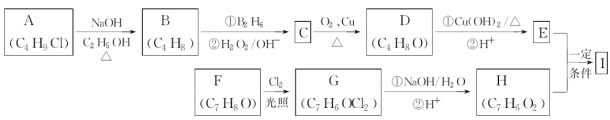
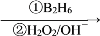 R—CH2CH2OH;
R—CH2CH2OH;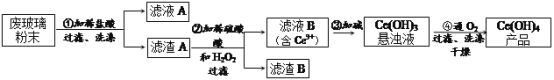
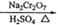 CH3CH2CH2CHO
CH3CH2CH2CHO