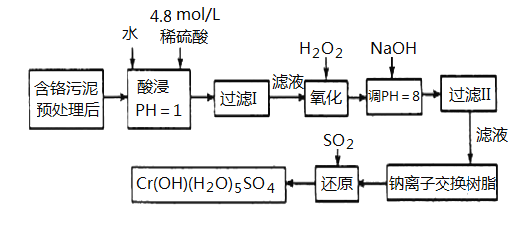
-
下列各组中的两种物质作用时,反应条件(温度、反应物用量、反应物浓度等)改变,不会引起产物改变的是( )
A. Na2O2和CO2 B. NaOH和CO2
C. Na和O2 D. Cu和HNO3
难度: 简单查看答案及解析
-
取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A. 0.21 mol·L-1 B. 0.42 mol·L-1
C. 0.56 mol·L-1 D. 0.26 mol·L-1
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
难度: 中等查看答案及解析
-
设
表示阿伏伽德罗常数的值,下列说法正确的是( )
A.
氢气中含有氢原子的数目为
B.标准状况下,
苯中含有苯分子的数目为
C.
溶液中含有氯离子的数目为
D.
与足量水反应,转移的电子数为
难度: 简单查看答案及解析
-
把500
有BaCl2和KCl的混合溶液分成5等份,取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是( )
A.将5.85 g NaCl固体放入1 000 mL容量瓶,加水溶解并准确定容
B.称量时,将固体NaCl直接放在天平左盘上
C.固体溶解后,冷却后将溶液直接转移到容量瓶中,然后向容量瓶中加水至刻度线
D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果
难度: 中等查看答案及解析
-
用如图所示实验装置进行相关实验探究,其中装置不合理的是( )
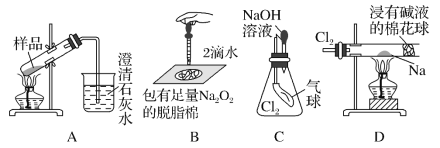
A.鉴别纯碱与小苏打 B.证明Na2O2与水反应放热
C.证明Cl2能与烧碱溶液反应 D.探究钠与Cl2反应
难度: 简单查看答案及解析
-
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是 ( )
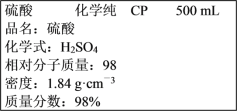
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应,标准状况下产生22.4 L气体时,转移的电子数为NA
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol·L-1
难度: 困难查看答案及解析
-
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是( )
A.溶质的质量分数w=a/(ρV-a)×100%
B.溶质的物质的量浓度c=1000a/35V mol·L-1
C.溶液中c(OH-)=1000b/V mol·L-1+c(H+)
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
难度: 中等查看答案及解析
-
配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸
C.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
难度: 简单查看答案及解析
-
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数的值)
难度: 中等查看答案及解析
-
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。下表中由实验现象得出的结论完全正确的是( )
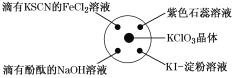
选项
实验现象
结论
A
滴有KSCN的FeCl2溶液变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液褪色
Cl2具有酸性
C
紫色石蕊溶液先变红后褪色
Cl2具有漂白性
D
KI淀粉溶液变成蓝色
Cl2具有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )
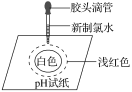
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色
B.Na2O2与CO2反应生成0.1 mol O2时转移电子0.4 mol
C.Na2O2投入到CuCl2溶液中有蓝色沉淀及气泡产生
D.向饱和烧碱溶液中加入2 g Na2O2,充分反应完后,溶液中c(Na+)不变
难度: 中等查看答案及解析
-
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C物质的以下性质错误的是
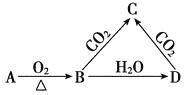
A.溶液呈碱性 B.与澄清石灰水反应产生白色沉淀
C.受热易分解 D.与足量盐酸反应放出气体
难度: 中等查看答案及解析