-
《新科学家》网站报道,科学家通过电解Fe2O3、SiO2、CaO的熔融液(1600℃)制得了铁.下列有关该方法与常规工业冶铁方法相比说法错误的是( )
A.制得纯度更高的铁
B.产生副产品氧气
C.减少温室气体排放
D.大幅度降低能耗难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.硝基苯的结构简式:
B.Cl-的结构示意图:
C.丙烷的分子球棍模型示意图:
D.H216O、D216O、H218O、D218O互为同素异形体难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.标准状况下,2.24L Cl2与过量的稀NaOH 溶液反应,转移电子总数为0.2NA
D.常温常压下,46g NO2与N2O4的混合气体中含有的原子总数为3NA难度: 中等查看答案及解析
-
下列除杂所用试剂和操作均合理的是( )
选项 物质(括号中为杂质) 除杂试剂 操作 A 铁屑(汽油) 热纯碱溶液 洗涤 B BaCO3(BaSO4) 饱和Na2CO3溶液 搅拌、过滤 C 苯(苯酚) NaOH (aq) 蒸馏 D 氯化氢(Cl2) 饱和食盐水 洗气
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是学( )
A.含有大量I-的溶液:H+、Fe3+、Cl-、NO3-
B.加入铝粉能放出大量H2的溶液:K+、NH4+、SO42-、HCO3-
C.常温下pH=7的溶液:Fe3+、Na+、Cl-、NO3-
D.常温下c(OH-)/c(H+)=1012的溶液:K+、Ba2+、Cl-、Br-网难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍.下列说法正确的是( )
A.Z元素形成的某种氧化物能使品红溶液褪色
B.X和Z的最高价氧化物对应的水化物都是弱酸
C.X与Y元素形成的化合物的相对分子质量是100g•mol-1
D.Y元素形成的单质能在氧气中燃烧但不能在二氧化碳中燃烧难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验,能达到实验目的是( )
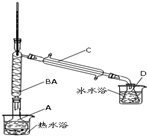
A.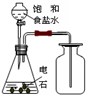
制取并收集乙炔
B.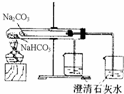
比较NaHCO3、Na2CO3对热稳定性
C.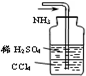
吸收多余的NH3
D.
实验室中制取少量乙酸乙酯难度: 中等查看答案及解析
-
魔棒发光原理是利用H2O2氧化草酸二酯(CPPO)产生能量,该能量被传递给荧光物质后发出荧光.草酸二酯结构简式如图所示,下列有关草酸二酯的说法正确的是( )
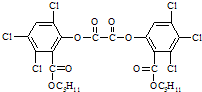
A.草酸二酯属于芳香烃
B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水
D.1mol草酸二酯最多可与4mol NaOH反应难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+4H++2Cl-Cl2↑+Mn2++2H2O
B.往5mL浓氨水中滴加5滴0.1mol•L-1的氯化铝溶液:Al3++4OH-=AlO2-+2H2O
C.H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
D.尼泊金酸()与碳酸氢钠溶液反应:
难度: 中等查看答案及解析
-
铅蓄电池在现代生活中有广泛应用,其电极材料是Pb和PbO2,电解液是硫酸溶液.现用铅蓄电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.蓄电池放电时,每消耗0.1molPb,共生成0.1mol PbSO4
B.电解硫酸钠溶液时的阳极反应式为:4OH--4e-=2H2O+O2↑
C.电解后,硫酸钠溶液中有晶体析出,但c(Na2SO4)会变小
D.蓄电池放电一段时间后其电解液中H2SO4的浓度、密度都变小难度: 中等查看答案及解析
-
某酸性溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法正确的是( )
A.溶液中离子浓度可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.该溶液可由等物质的量浓度、等体积的盐酸和氨水混合而成
C.可由pH=3的盐酸与pH=11的氨水等体积混合而成
D.再通入适量氨气,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图甲所示[t~t1阶段 c(B)未画出].图乙为t2后改变互不相同的某一条件反应速率随时间变化的关系图,t3~t4阶段使用了催化剂.下列说法错误的是 ( )
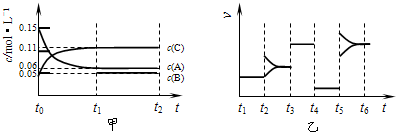
A.若 t1=15 s,生成物C在 t~t1时间段的平均反应速率为 0.004mol•L-1•s-1
B.t4~t5阶段改变的条件为减小压强,t5~t6改变的条件是升高化学反应的温度
C.B的起始物质的量为0.02mol
D.该化学反应的表达式为:3A⇌B+2C难度: 中等查看答案及解析