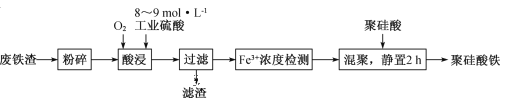
-
在探究下列物质性质或组成的实验中,结论不正确的是( )
A.将二氧化硫通入酸性KMnO4溶液中,紫色褪去,证明二氧化硫有还原性
B.向某溶液中加入KSCN溶液,溶液变成红色,证明原溶液中含有Fe3+
C.将铝片放入冷浓硝酸中,无明显现象,证明浓硝酸与铝片不反应
D.向某无色溶液中加入氢氧化钠溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,证明原溶液中一定有NH4+
难度: 简单查看答案及解析
-
向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入a mol铁粉,充分反应后,下列说法正确的是( )
A.当a≤1时,发生的反应为Fe+Cu2+=Fe2++Cu
B.当固体有剩余时,溶液中一定存在Fe2+、Cu2+
C.当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol
D.若有固体剩余,则固体中一定有铁,可能有铜
难度: 简单查看答案及解析
-
下列实验方案、现象、得出的结论均正确的是( )
选项
实验及现象
结论
A
用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰
该样品含钠元素
B
向NaHCO3溶液中加入过量盐酸振荡、静置、有气泡产生
证明非金属性Cl>C
C
向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀
证明SO2被氧化为SO42-
D
常温下向氯化铵溶液中加入少量氨水使溶液至中性
c(NH4+)=c(Cl-)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=12的溶液:Na+、K+、NO3-、ClO-
B.能使甲基橙变红的溶液:Na+、NH4+、Cl-、CH3COO-
C.1.0 mol·L-1的KNO3溶液:Fe2+、H+、SO42-、I-
D.0.1 mol·L-1 Ba(OH)2溶液:Al3+、NH4+、NO3-、HCO3-
难度: 中等查看答案及解析
-
“爆竹声中一岁除,春风送暖入屠苏。千门万户瞳瞳日,总把新桃换旧符。”是王安石的作品《元日》,其中的“屠苏”是一种酒。下列说法错误的是( )
A.黑火药是由硫黄、硝石和木炭按照一定比例混合而成
B.“屠苏”中不含非电解质
C.爆竹爆炸发生了化学变化
D.早期的桃符大都是木质的,其主要成分纤维素可以发生水解反应
难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是( )
A.磁性氧化铁溶于足量的稀硝酸中:3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O
B.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3-
C.碘化钾溶液酸化后加入少量双氧水:2H++2I-+H2O2=I2+2H2O
D.向NaOH溶液中通入过量CO2:2OH-+CO2=CO32-+H2O
难度: 困难查看答案及解析
-
下列关于化学用语的表示正确的是( )
A.氮气的电子式:N⋮⋮N
B.熔融状态下硫酸氢钾的电离方程式:KHSO4
K++H++SO42-
C.质子数为53,中子数为78的碘原子:
I
D.丙烯的结构简式:CH3CHCH2
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.N2(g)
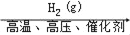 NH3(g)
NH3(g)NH4Cl(aq)
B.Fe(s)
FeCl2(s)
Fe(OH)2(s)
C.MgO(s)
MgSO4(aq)
Mg(s)
D.S(s)
SO2(g)
BaSO3(s)
难度: 简单查看答案及解析
-
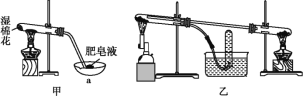
实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( )
A.
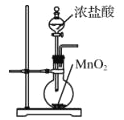 制取Cl2
制取Cl2B.
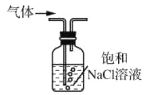 除去Cl2中的少量HCl
除去Cl2中的少量HClC.
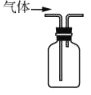 收集Cl2
收集Cl2D.
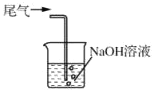 吸收尾气中的Cl2
吸收尾气中的Cl2难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
难度: 中等查看答案及解析
-
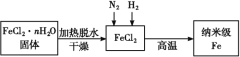
短周期主族元素X、Y、Z、W原子序数依次增大,X的原子核内只有一个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W单质在常温下能被浓硫酸钝化。下列说法正确的是
A.原子半径:Y<Z<W B.简单离子半径:Z> W
C.X、Y形成的化合物只含有极性键 D.Y的最高价氧化物对应水化物酸性比Z的强
难度: 中等查看答案及解析
-
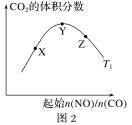
下列图示与对应的叙述相符的是
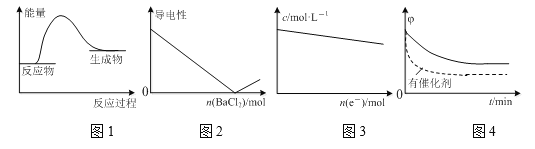
A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
难度: 中等查看答案及解析
-
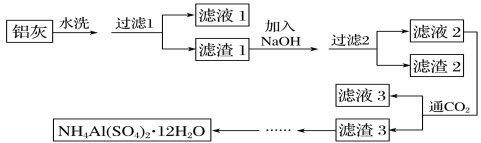
(Ga)与铝同主族,曾被称为“类铝”,其氧化物、氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是( )
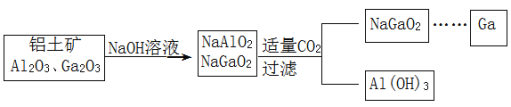
A.Al、Ga均处于ⅢA族
B.Ga(OH)3可与NaOH反应生成 NaGaO2
C.酸性:Al(OH)3>Ga(OH)3
D.Ga2O3可与盐酸反应生成GaCl3
难度: 简单查看答案及解析
-
氧化亚铜常用于制船底防污漆。用CuO与Cu高温烧结可制取
,已知反应:
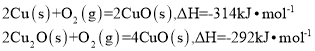
则
的
等于
A.
B.
C.
D.
难度: 简单查看答案及解析
-
海洋电池,是以铝合金为电池负极,金属(Pt、Fe)网为正极,科学家把正极制成仿鱼鳃的网状结构。用海水为电解质溶液,它靠海水中的溶解氧与铝反应产生电能的。海水中只含有0.5%的溶解氧。不放入海洋时,铝极就不会在空气中被氧化,可以长期储存。用时,把电池放入海水中,便可供电, 电池设计使用周期可长达一年以上,避免经常交换电池的麻烦。即使更换,也只是换一块铝合金板,电池总反应式:4Al+3O2十6H2O=4Al(OH)3↓下列说法错误的是
A.负极铝被氧化
B.海水温度升高,电池反应速率可能加快
C.正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积
D.正极电极反应式为O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
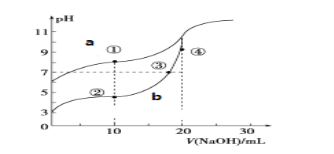
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
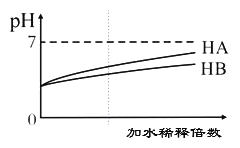
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
难度: 困难查看答案及解析