-
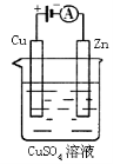
在Na2S溶液中c(Na+)与c(S2-)的比值是
A.2 B.小于2 C.大于2 D.1/2
难度: 简单查看答案及解析
-
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Fe和AgNO3溶液 D.Pt和Ag2SO4溶液
难度: 中等查看答案及解析
-
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
A.H2+2OH-=2H2O+2e- B.O2+4H++4e-=2H2O
C.H2 -2e-=2H+ D.O2+2H2O+4e-=4OH-
难度: 中等查看答案及解析
-
能使0.1mol/LCH3COONa溶液的pH值增大的方法是
A.加水 B.加盐酸 C.加热 D.加氯化铵晶体
难度: 简单查看答案及解析
-
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 B.2Fe+2H2O+O2=2Fe(OH)2
C.2H2O+O2+4e-=4OH- D.Fe-3e-=Fe3+
难度: 简单查看答案及解析
-
0.1mol/L某溶液的pH值为5.1,其溶液中的溶质可能是
A.氯化氢 B.BaCl2 C.氯化铵 D.硫酸氢钠
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干下列物质的水溶液并灼烧(低于400℃),可以得到该物质的固体的是
A.氯化铝 B.碳酸氢钠 C.硫酸镁 D.高锰酸钾
难度: 简单查看答案及解析
-
25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH4+)=c(Cl-),则溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
难度: 中等查看答案及解析
-
CaSO4有很多用途,例如制豆腐就用到石膏(主要成分是CaSO4)。CaSO4微溶于水,溶于水的部分可以形成CaSO4饱和溶液,其饱和溶液中存在平衡:CaSO4(s)
Ca2+(aq)+SO42-(aq),分别采取下列措施,能使溶液中c(Ca2+)增大的是
A.降温 B.加入CaSO4 C.加入BaCl2 D.加水
难度: 中等查看答案及解析
-
下列各组离子中能在溶液中大量共存,且溶液呈碱性透明的是
A、Na+、OH-、H2PO4-、NO3- B、AlO2-、K+、CO32-、Na+
C、Al3+、Cl-、AlO2-、Na+ D、Fe2+、K+、H+、NO3-
难度: 简单查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b上产生大量气泡。则四种金属的活动性顺序由强到弱的是
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后
A.溶液的pH变大 B.c(Na+)与c(CO32-)的比值变大
C.溶液浓度变大,有晶体析出 D.溶液浓度不变,有晶体析出
难度: 简单查看答案及解析
-
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为
Pb+PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是
A.Pb 为正极被氧化
B.溶液的pH不断减小
C.放电时负极反应式是PbO2 +4H++ SO42-+2e-= PbSO4 +2H2O
D.溶液pH不断增大
难度: 中等查看答案及解析
-
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是
A.c(OH-)>c(HA)>c(HB)>c(H+) B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+) D.c(OH-)>c(HB)>c(HA)>c(H+)
难度: 中等查看答案及解析
-
关于如图所示的原电池,下列说法正确的是
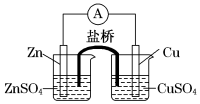
A.电子从铜电极通过检流计流向锌电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.锌电极发生还原反应,铜电极发生氧化反应
D.铜电极上发生的电极反应是2H++2e-===H2↑
难度: 中等查看答案及解析
-
下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是
A.Cu、Ag、AgNO3溶液 B.Zn、Cu、稀H2SO4
C.Fe、Zn、ZnSO4溶液 D.Fe、C、Fe2(SO4)3溶液
难度: 中等查看答案及解析
-
如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡。小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是

 A.铁圈和银圈左右摇摆不定 B.保持平衡状况
A.铁圈和银圈左右摇摆不定 B.保持平衡状况C.铁圈向下倾斜 D.银圈向下倾斜
难度: 中等查看答案及解析
-
草酸是中强酸,草酸氢钾溶液呈酸性。在0.1 mol·L-1 KHC2O4溶液中,下列关系正确的是
①c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
②c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
③c(C2O42-)>c(H2C2O4)
④c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A.①② B.①④ C.③④ D.②③
难度: 中等查看答案及解析
-
25 ℃时,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
难度: 困难查看答案及解析
-
25 ℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是
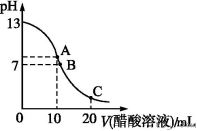
 A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
A.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)B.在B点:c(OH-)=c(H+),c(Na+)= c(CH3COO-))
C.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
难度: 困难查看答案及解析