-
钠露置在空气中,其变质过程中不可能产生的物质是( )
A. Na2O B. NaOH C. Na2CO3 D. NaHCO3
难度: 简单查看答案及解析
-
已知amol H2和bmol H2O中所含的原子个数相等,则a∶b的值为( )
A. 1∶1 B. 1∶3
C. 3∶2 D. 任意比
难度: 简单查看答案及解析
-
标准状况下,两个容积相等的贮气瓶,一个装有O2,另一个装有CH4,两瓶气体具有相同的
A. 密度 B. 分子数 C. 质量 D. 原子总数
难度: 简单查看答案及解析
-
下列物质中属于电解质的是( )
A. 二氧化碳 B. 食盐水 C. 蔗糖 D. 烧碱
难度: 简单查看答案及解析
-
金属和金属材料与人们的日常生活密不可分,下列认识错误的是
A. 一般用铜而不用银作导线,主要是由于考虑价格的因素
B. 铁制品比铝制品容易腐蚀,是由于铁的化学性质比铝活泼
C. 用盐酸可区分假黄金,是由于金不能与盐酸反应,而锌能与盐酸反应
D. 用硫酸铜配制的波尔多液不能用铁制容器盛放,是因为铁能与硫酸铜发生反应
难度: 简单查看答案及解析
-
下列关于金属通性的叙述不正确的是( )
A. 在反应中金属原子易失去最外层上的电子
B. 金属单质只具有还原性,而不具有氧化性
C. 金属元素在化合物中不可能为负价
D. 金属单质都能与盐酸溶液发生置换反应
难度: 简单查看答案及解析
-
起固定氮作用的化学反应是
A.氮气与氢气在一定条件下反应生成氨气
B.一氧化氮与氧气反应生成二氧化氮
C.氨气经催化氧化生成一氧化氮
D.由氨气制碳酸氢铵和硫酸铵
难度: 简单查看答案及解析
-
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用Na2SeO3清除人体内活性氧,Na2SeO3的作用是( )
A.还原剂 B.氧化剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
难度: 中等查看答案及解析
-
向碘水中加入适量CCl4并振荡,静置后观察到的现象是
A.形成均匀的无色溶液
B.形成均匀的紫红色溶液
C.液体分层,下层呈紫红色
D.液体分层,上下层均呈无色
难度: 中等查看答案及解析
-
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
难度: 简单查看答案及解析
-
下列关于酸、碱、盐的说法中正确的是( )
A.酸根中不可能含有氧元素 B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐 D.酸不可能电离产生金属阳离子
难度: 中等查看答案及解析
-
一个一氧化氮分子的质量为a g,一个二氧化氮分子的质量为b g,NA表示阿伏加德罗常数,则氧原子的摩尔质量为( )
A. (a-b)NA g·mol-1 B. (b-a)NA g·mol-1 C. (a-b)NA g D. (b-a)NA g
难度: 简单查看答案及解析
-
同温同压下,等体积的一氧化二氮(N2O)和二氧化碳两种气体相比较:①质量相等、②所含碳原子数与氮原子数相等、③所含分子数相等。上述结论中正确的是( )
A. ①②③ B. ②③ C. ①② D. ①③
难度: 简单查看答案及解析
-
铁不能与冷、热水反应,但能与水蒸气反应。下列说法不正确的是( )
A.组装该实验装置用到的玻璃仪器可仅为1个酒精灯、1支大试管和导气管
B.可通过加热湿棉花产生水蒸气
C.可将产物之一通入肥皂液中用燃烧法检验
D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
难度: 简单查看答案及解析
-
下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有强氧化性,SO2、H2、CO具有还原性,故浓硫酸不能干燥SO2、H2、CO
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取SO2时,浓硫酸表现出强氧化性
难度: 中等查看答案及解析
-
向含有HCO3-、CO32-、NO3-、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减少的是( )
A.HCO3- B.CO32- C.NO3- D.Na+
难度: 中等查看答案及解析
-
赏心悦目的雕花玻璃通常是用某种物质对玻璃进行刻蚀而制成的,则这种物质是( )
A. 盐酸 B. 氢氟酸 C. 烧碱 D. 纯碱
难度: 中等查看答案及解析
-
下列物质中属于纯净物的是( )
A.氯水 B.液氯 C.次氯酸溶液 D.液态空气
难度: 简单查看答案及解析
-
下列化学反应方程式中有一个与其他三个在分类上不同,这个反应是( )
A. S+O2
SO2
B. Na2CO3+CO2+H2O===2NaHCO3
C. NH4HCO3
NH3↑+CO2↑+H2O
D. CO2+C
2CO
难度: 简单查看答案及解析
-
下列变化过程中失去电子的是( )
A. Fe3+→Fe2+ B.
→ Mn2+
C. Cl-→Cl2 D. N2O3→HNO2
难度: 简单查看答案及解析
-
四氯化硅(SiCl4)是制造半导体材料硅的中间原料,在空气中容易吸收水蒸气生成原硅酸(H4SiO4)和氯化氢而产生白色烟雾,下列说法正确的是( )
A.由四氯化硅转化为原硅酸的过程中,硅元素化合价发生了改变
B.原硅酸与硅酸中硅元素化合价不同
C.原硅酸与硅酸分别对应的酸性氧化物不同
D.四氯化硅应密封保存
难度: 简单查看答案及解析
-
下列各组溶液,只要用试管和胶头滴管,不用任何化学试剂就可以鉴别的是
A. HCl和Na2CO3 B. 稀H2SO4和NaHCO3
C. CaCl2和Na2CO3 D. Ba(OH)2和NaHSO4
难度: 中等查看答案及解析
-
下列物质在相应条件下能发生电离而导电的是( )
A.液态氯化氢 B.熔融氯化钠
C.固体氢氧化钾 D.高温熔化后的单质铁
难度: 简单查看答案及解析
-
下列关于物质的量的说法中正确的是( )
A.物质的量是人们主观规定的基本物理量之一
B.物质的量实质上就是物质的质量
C.物质的量是人们根据其他的物理量推导出来的新的物理量
D.物质的量是一种物理量的单位
难度: 简单查看答案及解析
-
检验Cl―时所用试剂中稀HNO3的作用是 ( )
A.防止CO32―的干扰 B.防止Cl―的干扰
C.生成Ag2CO3沉淀 D.防止NO3―的干扰
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 将金属钠置于空气中加热产生白色的氧化钠
B. 铝箔不易被点燃是因为铝与空气中的氧气不反应
C. 铁在空气中点燃剧烈反应,火星四射
D. 钠与氧气反应,本身作还原剂
难度: 简单查看答案及解析
-
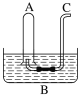
将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( )
A.2/3 B.1/2 C.1/3 D.1/4
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,将22.4L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA
B.常温常压下,16gCH4所含中子数目为8NA
C.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
D.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA
难度: 中等查看答案及解析
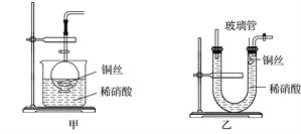
 E.
E.