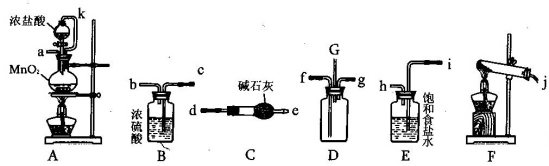
-
下列排列顺序不正确的是
A.熔点:Al>K>Na B.微粒的半径:Cl﹣>Na+>Mg2+>A13+
C.热稳定性:HF>HCl>HBr>HI D.仅结合质子能力:AlO2﹣>CO32﹣>F﹣
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.在反应中消耗1mol Cl2,转移的电子数一定为2NA。
B.标准状况下,0.5mol氦气含有的电子数为NA
C.15g CH3+(碳正离子)中含有电子数为10NA
D.0.1L 2mol·L﹣1的(NH4)2S溶液中含有的S2﹣数目为0.2NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2
B.澄清石灰水与少量小苏打溶液混合:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O
C. AlCl3溶液中加入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O
D.向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结论
A
向等浓度且较稀的NaCl、KI混合
液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
B
向溶液x中滴加浓NaOH溶液,
将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
C
溴乙烷与NaOH溶液共热后,加入
AgNO3溶液
未出现淡黄色沉淀
溴乙烷没有发生水解
D
将SO2通入溴水中
溴水褪色
SO2具有还原性
难度: 中等查看答案及解析
-
某小分子抗癌药物的分子结构如题图所示,下列说法正确的是

A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
难度: 中等查看答案及解析
-
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如题6图.下列说法正确的是
A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
难度: 中等查看答案及解析
-
化学平衡状态I、II、III的相关数据如下表:
编号
化学方程式
平衡常数
温度
979K
1173K
I
Fe(s)+CO2(g)
2 FeO(s)+CO(g)
K1
1.47
2.15
II
CO(g)+H2O(g)
CO2(g)+H2(g)
K2
1.62
b
III
Fe(s)+H2O(g)
FeO(s)+H2(g)
K3
a
1.68
根据以上信息判断,下列结论错误的是
A.a>b B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应
难度: 简单查看答案及解析