-
2009年12月,世界气候大会在哥本哈根举行,我国政府承诺,到2020年我国二氧化碳排放总量比2005年下降40%-45%。为实现上述目标,我们提倡“低碳生活”方式。以下说法不正确的是( )
A.限制化工发展,关停化工企业,消除污染源头
B.出行时少开私车,多乘坐公共交通工具或以自行车代步
C.少用空调,温控适度(夏季26℃以上,冬季20℃以下),多走楼梯,少乘电梯
D.发展水电,开发新能源,如核能、太阳能、风能等,减少对化石能源的依赖
难度: 简单查看答案及解析
-
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A.加入一种反应物 B.增大体系的压强 C.升高温度 D.使用催化剂
难度: 简单查看答案及解析
-
关于晶体的下列说法正确的是( )
A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.晶体中分子间作用力越大,分子越稳定
难度: 简单查看答案及解析
-
在 0.1mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述中,正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中C(H+) 减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 简单查看答案及解析
-
2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象。已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:2KIO3 + 6NaHSO3
2KI + 3Na2SO4 + 3H2SO4,下列说法中不正确的是( )
A.23Na37Cl中质子数和中子数之比是7:8 B.KIO3和NaHSO3都是强电解质
C.KIO3作氧化剂发生氧化反应 D.生成1mo1 KI时,转移6 mo1电子
难度: 简单查看答案及解析
-
在恒温恒容的密闭容器中进行的气体反应:H2(g)+Br2(g)
2HBr(g),能说明反应已达平衡状态的是 ( )
A.容器内混合气体颜色不随时间改变而改变 B.H2、Br2的反应速率相等
C.容器内的压强不随时间改变而改变 D.混合气体的密度不随时间改变而改变
难度: 简单查看答案及解析
-
既有离子键又有共价键和配位键的化合物是( )
A.NH4NO3 B.NaOH C.H2SO4 D.H2O
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH- +H+ + SO4 2- = BaSO4↓+H2O
B.用石墨作电极电解氯化镁溶液:2Cl- +2H2O=Cl2↑+H2↑+2OH-
C.向Ca(OH)2溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2+ + HCO-3 + OH- = CaCO3↓ + H2O
D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+=Fe3++4H2O
难度: 简单查看答案及解析
-
下列实验方案能达到预期目的的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼V(钒),铝作还原剂
A.②④⑤ B.①②⑤ C.①②④ D.②③④
难度: 简单查看答案及解析
-
阿伏加德罗常数的值约为6.02×1023,下列说法正确的是( )
A.l.8 g
O2分子与1.8 g
O3分子中含有的中子数不相同
B.标准状况下,22.4LCCl4中共价键数为4NA
C.80 mL 10 mol·L–1浓盐酸与足量MnO2反应,转移电子数为0.4×6.02×1023
D.常温常压下,6.02×1023个SO3分子所占的质量约为80 g
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,正确的是( )
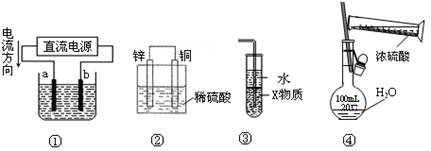
A.若采用装置①精炼铜,则a极为纯铜, b极为粗铜,电解质溶液为CuSO4溶液
B.装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C.装置③中X若为四氯化碳,则此装置可用于吸收氨气,并防止倒吸
D.装置④可用于实验室配制一定物质的量浓度的稀硫酸
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知2H2(g)+O2(g)
2H2O(g) ΔH =-483.6 kJ·mol–1 ,则氢气的燃烧热为241.8 kJ·mol–1
B.已知C(石墨,s)
C(金刚石,s) ΔH>0 ,则石墨比金刚石稳定
C.已知OH–(aq)+H+(aq)
H2O(l) ΔH=-57.4 kJ·mol–1 ,则含20.0 g NaOH的稀溶液与CH3COOH的稀溶液完全中和,放出的热量等于28.7 kJ
D.已知2C(s)+2O2(g)
2CO2(g) ΔH1 2C(s)+O2(g)
2CO(g) ΔH2 ,则ΔH1>ΔH2
难度: 简单查看答案及解析
-
下列各组离子在碱性条件下能大量共存,而在强酸性条件下也能发生氧化还原反应的是
A. Mg2+、Na+、SO42-、Cl- B. K+、CO32-、Cl-、NO3-
C. Na+、K+、NO3-、SO32- D. NH4+、Na+、SO42-、NO3-
难度: 简单查看答案及解析
-
下列各表述与示意图一致的是( )

A.图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH体积的关系图。则:n(Mg2+):n(Al3+):n( NH4+)=2:3:2
B.图①中使用的NaOH的物质的量浓度为1 mol/L
C.图②中曲线表示某反应过程的能量变化。若使用催化剂,B点会降低
D.图②中物质A反应生成物质C,△H>0
难度: 简单查看答案及解析
-
下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
难度: 简单查看答案及解析
-
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)
2XY3(g) △H=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
起始时各物质物质的量/mol
达平衡时体系能量的变化
X2
Y2
XY3
①
1
3
0
放热 23.15 kJ
②
0.6
1.8
0.8
Q(Q>0)
下列叙述不正确的是( )
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为Q
C.达到平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
难度: 简单查看答案及解析
-
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:Pb(s) + PbO2(s) + 2 H2SO4(aq)
2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )

A.d极为阴极
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l)
D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
难度: 简单查看答案及解析
-
下列实验操作中正确的是( )
A.除去N2中的少量O2:通过灼热的Cu网, 收集气体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
D.测溶液的PH值需先用蒸馏水润湿PH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,与标准比色卡对照
难度: 简单查看答案及解析
-
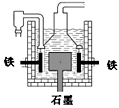
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)
4Na +O2↑+ 2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH
Fe3O4+2H2↑十4Na↑。
下列有关说法正确的是 ( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为:2OH--2e-=H2↑+O2↑
C.若戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
B.吕萨克法制钠原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨为阳极,铁为阴极
难度: 简单查看答案及解析
-
已知某可逆反应aA(g) + bB(g)
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图。下列叙述正确的是
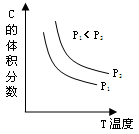
A.正反应为吸热反应 B.降低温度,正反应速率增大
C.a + b < c + d D.增大压强,逆反应速率增大
难度: 简单查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为
mol
③反应过程中转移的电子数为
mol
④生成NO气体的体积为
L
⑤与合金反应反应的硝酸的物质的量为
mol
A.2项 B.3项 C.4项 D.5项
难度: 简单查看答案及解析


