-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
小苏打受热易分解
焙制糕点
B
蛋白质受热变性
高温杀死流感病毒
C
SO2具有漂白性
漂白滋补品银耳等食品
D
Al(OH)3分解吸收大量热量并有水生成
阻燃剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加徳罗常数值。下列有关叙述正确的是
A. 2 molSO2与3 molO2反应生成的SO3分子数为2NA
B. 30 g乙酸和葡萄糖混合物中的氢原子数为2NA
C. 常温下pH = 12的NaOH溶液中,水电离出的氢离子数为10-12NA
D. 标准状况下,2.24 L C2H6含有的共价键数为0.6NA
难度: 简单查看答案及解析
-
下列关于有机化合物的说法错误的是
A. 石油分馏是物理变化,可获得汽油、煤油、柴油等产品
B. C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构)
C. 淀粉和纤维素水解的最终产物不同
D. 由乙酸生成乙酸乙酯属于取代反应
难度: 中等查看答案及解析
-
根据下列实验现象所得出的结论错误的是
选项
实验
现象
结论
A
向KBrO3溶液中加入少量苯,然后通入少量Cl2
有机层呈橙色
氧化性:Cl2> KBrO3
B
向KNO3和KOH混合溶液中加入铝粉并加热, 将湿润的红色石蕊试纸放在试管口
试纸变为蓝色
NO3-被还原为NH3
C
向0.1 mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热
红色加深
盐类水解是吸热反应
D
将0. 1 mol • L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1 mol•L-1的CuSO4溶液
白色沉淀逐渐变为蓝色沉淀
Ksp[Cu(OH)2]<
Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
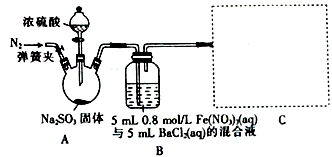
某同学通过右图所示装置探究铝制品表面出现的白斑,下列说法正确的是
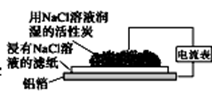
A. 铝箔为正极,发生氧化反应而被腐蚀 B. 负极反应为 2H2O+O2+4e-==4OH-
C. Cl-由活性炭区向铝箔表面区迁移,铝箔表面有氯气产生 D. 白斑的主要成分可能是是Al2O3
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子半径依次增大,其简单氢化物中X、Y、Z、W的化合价如下表所示:
元素
X
Y
Z
W
化合价
-1
-2
-2
-3
下列说法正确的是
A. 最高价氧化物对应水化物的酸性:W>Z B. 元素的非金属性:X>Y
C. 氢化物的沸点:Z>Y D. 元素Y不存在同素异形现象
难度: 中等查看答案及解析
-
25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=﹣lgKa).在此温度下向20mL0.1mol•L﹣1H2R溶液中滴加0.1mol•L﹣1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示.
下列有关说法正确的是( )
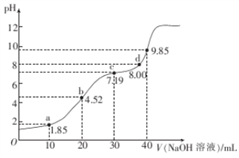
A. a点所示溶液中:c(H2R)+c(HR﹣)+c(R2﹣)=0.1mol•L﹣1
B. b点所示溶液中:c(Na+)>c(HR﹣)>c(H2R)>c(R2﹣)
C. c点所示溶液中:c(Na+)<3c(R2﹣)
D. d点所示溶液中:c(Na+)>c(R2﹣)>c(HR﹣)
难度: 困难查看答案及解析
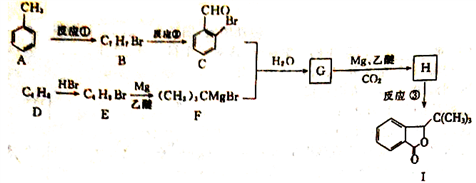
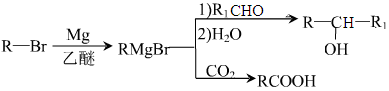
 )是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下:
)是国际上首个作用于急性缺血性脑猝中多个病理环节的创新药物,获国家科技进步二等奖。丁苯酞的一种合成路线如下: