-
下列实验操作中,一般情况下不应该相互接触的是( )
A.过滤操作中,漏斗末端与承接滤液的烧杯内壁
B.向容量瓶中转移液体时,使用的玻璃棒与容量瓶颈内壁
C.用胶头滴管向试管中滴液体时,滴管尖端与试管内壁
D.实验室将HCl气体溶于水时,漏斗口与水面
难度: 简单查看答案及解析
-
关于物质的分类正确的是( )
A.SO2、CO2、CO、NO2都是酸性氧化物
B.Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物
C.HCl、HClO、HNO3、HClO4都是强酸
D.NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱
难度: 简单查看答案及解析
-
氯化铁溶液与氢氧化铁胶体具有的共同性质是( )
A.分散质颗粒直径都在l~100nm之间 B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成 D.呈红褐色
难度: 简单查看答案及解析
-
下列除去杂质的方法正确的是( )
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤
C.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
难度: 中等查看答案及解析
-
下列实验操作中,仪器需插入液面下的有( )
①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;
②制备氢气,简易装置中长颈漏斗的下端管口;
③分馏石油时,测量温度所用的温度计;
④用乙醇制乙烯时所用的温度计;
⑤用水吸收氨气时的导气管;
⑥向试管中的BaCl2溶液中滴加稀硫酸时的胶头滴管
A.①②④ B.③⑤ C.③⑤⑥ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)mol/L B.10( 2a-b)mol/L C.10(b-2a)mol/L D.10(b-a)mol/L
难度: 中等查看答案及解析
-
同温同压下,等体积的两容器内分别充满NO和13CO气体,下列对两容器中气体的判断正确的是A.中子数相同 B.分子数不同 C.质子数相同 D.气体质量相同
难度: 简单查看答案及解析
-
下列有关实验的说法正确的是( )
A.实验室配制FeCl3溶液时加入铁粉和稀盐酸
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
D.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32-
难度: 中等查看答案及解析
-
下列溶液中,各组离子一定能大量共存的是( )
A.在强酸性溶液中:K+、NH4+、SO42-、ClO-
B.能使石蕊试液呈蓝色的溶液中:Na+、I-、Cl-、NO3-
C.在pH=1的溶液中:SO42-、Fe2+、Mg2+、NO3-
D.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O =SO32-+2HClO
B.Na2S水解:S2- + 2H2O
H2S + 2OH-
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2+ +2OH-= BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-= NH3↑+H2O
难度: 中等查看答案及解析
-
有三种说法:①NH4NO3中氮元素显+5价; ②4FeS2+11O2 → 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是
A.只有①B.只有②③C.只有①③D.①②③
难度: 中等查看答案及解析
-
北京2008奥运会金牌为金镶玉,直径为70mm,厚6mm。某化学兴趣小组对金牌中金属的成分提出猜想:甲认为该金属是由纯金制成;乙认为该金属是由金银合金制成;丙认为该金属是由黄铜(铜锌合金)制成。为了验证他们的猜想,取制造这种金牌的材质粉末少量进行实验,加入下面一种试剂来证明甲、乙、丙猜想的正误,该试剂应是( )
A.硫酸铜溶液 B.盐酸 C.稀硝酸 D.硝酸银溶液
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是( )
A.NF3是氧化剂,H2O是还原剂
B.若生成0.2 mol HNO3,则转移0.2 mol电子
C.还原剂与氧化剂的物质的量之比为2∶1
D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的是( )
①取a克混合物充分加热,减轻b克
②取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
③取a克混合物与足量稀硫酸充分反应,逸出气体先用浓硫酸干燥再用碱石灰吸收,碱石灰增重b克
④取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
A.只有①②④ B.①②③④ C.只有①③④ D.只有①②③
难度: 中等查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液中滴入酚酞变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航天员的供氧剂
Na2O2能和CO2和H2O反应生成O2
Ⅰ对,Ⅱ对,有
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023 mol—1,下列叙述中正确的是( )
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L甲苯所含的分子数约为6.02×1023
D.标准状况下,a L乙烷气体中的所含化学键数约为(a/22.4)×6.02×1023
难度: 中等查看答案及解析
-
向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是( )
A.K+、Br-、CO32- B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42- D.Ag+、Cu2+、NO3-
难度: 中等查看答案及解析
-
某温度下,饱和石灰水的溶解度为s g ,密度为 ρg/mL,向足量该饱和溶液中加入 m g CaO,
充分作用后,恢复到原来温度,下列有关说法不正确的是( )
A.最终得到沉淀的质量大于
B.该饱和溶液质量百分比浓度为:
C.最终所得溶液PH不变
D.该饱和溶液中溶质物质的量浓度为:
mol/L
难度: 困难查看答案及解析
-
1986年,人们成功的用如下反应制得了氟:
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2 ②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑ 则下列说法中正确的是( )
A.反应①、②、③都是氧化还原反应
B.反应①H2O2既是还原剂又是氧化剂
C.氧化性:KMnO4>O2
D.每生成1mol F2,上述反应共转移2mol电子
难度: 困难查看答案及解析
-
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应。则X为( )
A.ClO2 B.Cl2O C.Cl2 D.Cl2O3
难度: 中等查看答案及解析
-
下列实验中,溶液颜色有明显变化的是 ( )
A.少量明矾溶液加入到过量NaOH溶液中
B.往FeCl2溶液中滴入KI溶液,再滴入淀粉溶液
C.少量Na2O2固体加入到过量NaHSO3溶液中
D.往酸性高锰酸钾溶液中滴入足量FeSO4浓溶液
难度: 简单查看答案及解析
-
浓度均为0.1mol·L—1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
A、BaCl2 、 NaOH 、 NaHCO3 B、Na2CO3 、MgCl2 、 H2SO4
C、AlCl3 、 NH3·H2O 、 NaOH D、Ba(OH)2 、 CaCl2 、 Na2SO4
难度: 中等查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )
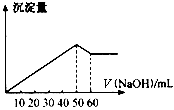
A.6:1 B.3:1
C.2:1 D.1:2
难度: 中等查看答案及解析
-
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是( )
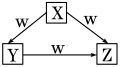
X
Y
Z
W
A
C
CO
CO2
O2
B
Na
Na2O
Na2O2
O2
C
AlCl3
Al(OH)3
NaAlO2
NaOH
D
Fe
FeCl2
FeCl3
Cl2
难度: 中等查看答案及解析
-
用下面的方案进行某些离子的检验,其中方案设计得最严密的是( )
A.检验试液中的SO
:试液
无沉淀
白色沉淀
B.检验试液中的Fe2+:试液
无明显现象
红色溶液
C.检验试液中的
:试液
棕黄色溶液
蓝色溶液
D.检验试液中的CO
:试液
白色沉淀
沉淀溶解
难度: 中等查看答案及解析