-
设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2 L CO2所含的原子数为1.5NA
B. 常温常压下,34 g OH-含有的质子数为20NA
C. 1L0.5mol·L-lFeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶粒
D. 标准状况下,22.4 L NH3所含电子数为10NA
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. SO2的摩尔质量为64 g
B. 气体的摩尔体积约为22.4 L·mol-1
C. 12 g12C中所含碳原子数即为阿伏加德罗常数
D. 4 g NaOH溶于1 L水所得溶液的物质的量浓度为0.1 mol·L-1
难度: 简单查看答案及解析
-
下列对于“摩尔”的理解正确的是
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.1mol氧气含1mol氧原子
D.1mol氢含6.02×1023个H2
难度: 简单查看答案及解析
-
下列仪器经常用于物质分离的有( )
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥容量瓶 ⑦蒸发皿 ⑧坩埚
A.①③⑤⑥ B.①②④⑥ C.①③⑤⑦ D.①③⑥⑧
难度: 简单查看答案及解析
-
能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是 ( )
A.NaNO3溶液 B.稀盐酸 C.KCl溶液 D.K2CO3溶液
难度: 简单查看答案及解析
-
下列各组物质,前者属于电解质,后者属于非电解质的是( )
A.NaCl、BaSO4 B.铜、二氧化硫
C.KOH、蔗糖 D.KNO3、硫酸溶液
难度: 中等查看答案及解析
-
下列关于0.1mol•L-1Ba(NO3)2溶液的正确说法是( )
A.该溶液可由1L水中溶解
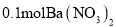 制得
制得B.1L该溶液中含有
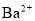 和
和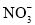 离子总数为
离子总数为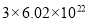 个
个C.
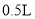 该溶液中
该溶液中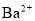 离子的物质的量浓度为
离子的物质的量浓度为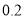

D.
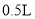 该溶液中
该溶液中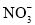 离子的物质的量浓度为
离子的物质的量浓度为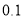

难度: 简单查看答案及解析
-
15g A物质和10.5g B物质完全反应,生成7.2g C物质,1.8g D物质和0.3mol E物质,则E的摩尔质量为
A.16.5 g·mol-1 B.85 g·mol-1 C.55 D.55 g·mol-1
难度: 简单查看答案及解析
-
胶体区别于其它分散系最本质的特征是
A.分散质粒子能透过半透膜 B.有丁达尔现象
C.胶体粒子直径在1~100nm之间 D.外观澄清、透明
难度: 简单查看答案及解析
-
下列关于氧化还原反应说法正确的是
A.有化合价升降的反应,不一定是氧化还原反应
B.某元素从化合态变成游离态,该元素一定被还原
C.有单质参加或生成的反应不一定是氧化还原反应
D.得电子越多,其氧化性越强
难度: 中等查看答案及解析
-
能用H+ + OH-= H2O 来表示的化学反应是:( )
A.
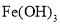 溶液和
溶液和 溶液反应 B.KOH溶液和
溶液反应 B.KOH溶液和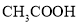 溶液反应
溶液反应C.NaOH溶液和
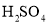 溶液反应 D.CuO溶于稀HCl
溶液反应 D.CuO溶于稀HCl难度: 中等查看答案及解析
-
若实际操作时需要分离下列两种混合物,选用最合适的实验装置是( )
a.煤油中不小心混入了大量的水;
b.水与丙酮的混合物,
已知:丙酮是一种可与水混溶的无色液体,密度小于苯,沸点约为56℃。
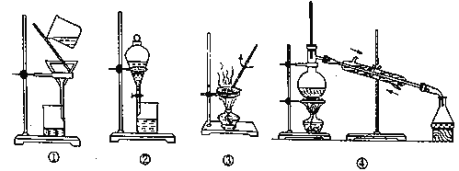
A.④③ B.②④ C.②① D.①③
难度: 简单查看答案及解析
-
200mL0.3mol/L的K2SO4溶液和100mL0.2mol/L Fe2(SO4)3溶液混合后不考虑混合后溶液体积的变化,溶液中
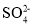 的物质的量浓度为 ( )
的物质的量浓度为 ( )A.0.3mol/L B.0.4mol/L
C.0.45mol/L D.0.5mol/L
难度: 简单查看答案及解析
-
下列物质的分类正确的是( )
碱
酸
盐
碱性氧化物
酸性氧化物
A.
Na2CO3
H2SO4
Cu2(OH)2CO3
Fe2O3
SO3
B.
NaOH
HCl
NaCl
Na2O
H2O
C.
NaOH
NaHSO4
CaF2
MgO
SO2
D.
KOH
HNO3
NaHCO3
CaO
Mn2O7
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
能正确表示下列化学反应的离子方程式正确的是( )
A.氢氧化镁与盐酸的反应
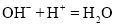
B.硫酸铜溶液与氢氢化钡溶液混合:
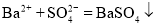
C.
 溶液与NaOH溶液反应:
溶液与NaOH溶液反应: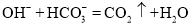
D.碳酸钙溶于稀盐酸中
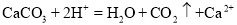
难度: 中等查看答案及解析
-
核内中子数为N 的R2+离子,质量数为A,则n 克它的氧化物中所含质子数的物质的量是( )
A.
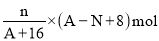 B.
B.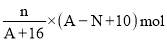
C.
 D.
D.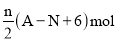
难度: 中等查看答案及解析
 C.CO
C.CO D.OH-。
D.OH-。