-
下列关于硅及其化合物的叙述正确的是
A. 陶瓷、玻璃、水泥都是硅酸盐产品
B. 硅晶体可用于制造光导纤维
C. 二氧化硅在电子工业中是重要的半导体材料
D. 二氧化硅与氢氟酸和氢氧化钠均能反应,属于两性氧化物
难度: 中等查看答案及解析
-
《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶…… ”文中未涉及下列操作原理的是
A.溶解 B.萃取 C.蒸馏 D.过滤
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是()
A.标准状况下,1.12L酒精含有分子数为0.05NA
B.0.1molFe与足量的Cl2反应,转移电子数为0.2NA
C.10gKHCO3和CaCO3的混合固体中,氧原子数为0.3NA
D.常温常压下,2.24LN2所含原子数为0.2NA
难度: 简单查看答案及解析
-
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,立即加水均稀释到50mL,此时X溶液和盐酸进行反应,其中反应速率最大的是( )
A.10mL 4mol/L的X溶液 B.30mL 2mol/L的X溶液
C.3mL 10mol/L的X溶液 D.15mL 3mol/L的X溶液
难度: 简单查看答案及解析
-
LiH是一种氢气发生剂,用于军事或其他需氢气的场合。反应为:LiH+H2O=LiOH+H2↑,在这个反应中( )
A.水是氧化剂,LiH是还原剂 B.LiH是氧化剂,水是还原剂
C.LiH既是氧化剂又是还原剂 D.该反应是非氧化还原反应,不存在氧化剂和还原剂
难度: 困难查看答案及解析
-
对可逆反应2A(s)+3B(g)
 C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动A.①② B.④ C.③ D.④⑤
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)
 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的是
2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此反应速率的表示正确的是A.用A表示的反应速率是0.4 mol·(L·min) -1
B.分别用B、C、D表示反应速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·(L·min) -1
D.在2 min内的反应速率,用C表示是0.3 mol·(L·min) -1
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1 NaHCO3溶液:
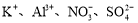
B.使蓝色石蕊试纸变红的溶液:
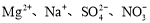
C.滴加KSCN溶液显红色的溶液:
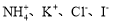
D.由水电离产生的
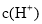 =1×10-12mol·L-1的溶液:
=1×10-12mol·L-1的溶液: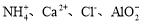
难度: 简单查看答案及解析
-
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线。下列叙述正确的是
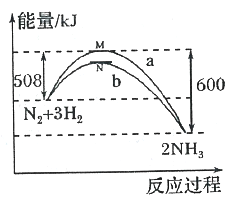
A. 状态M和N均表示2molN(g)+6mol H(g)
B. 该反应的热化学方程式为:N2+3H2
 2NH3 △H=-92kJ·mol-l
2NH3 △H=-92kJ·mol-lC. 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量
D. 使用催化剂,并不能改变反应的△H
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.大理石与稀盐酸反应制取CO2:
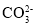 +2H+=CO2↑+H2O
+2H+=CO2↑+H2OB.氢氧化钡溶液与稀硫酸混合:H++OH-=H2O↓
C.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
D.硝酸银溶液与氯化钾溶液混合:Ag++Cl-=AgCl↓
难度: 简单查看答案及解析
-
利用如图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法正确的是
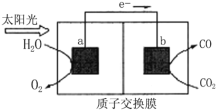
A.该装置工作时,H+从b极区向a极区移动
B.电极a表面发生还原反应
C.该过程至少涉及到3种能量的转化
D.该装置中每生成1molCO,同时生成1molO2
难度: 中等查看答案及解析
-
某有机物的结构简式如下,这种有机物不可能具有的性质是
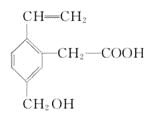
A.能使酸性KMnO4溶液褪色
B.能发生酯化反应
C.能跟NaOH溶液反应
D.能发生水解反应
难度: 中等查看答案及解析
-
分别进行下表所示实验,实验现象和结论均正确的是( )
选项
实验操作
现象
结论
A
测量熔融状态下NaHSO4的导电性
能导电
熔融状态下NaHSO4能电离出Na+、H+、SO42-
B
向某溶液中先加入氯水,再滴加KSCN溶液
溶液变红色
溶液中含有Fe2+
C
向浓度均为0.1mol/L的MgSO4、CuSO4的混合溶液中逐滴加入NaOH溶液
先看到蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
将AlCl3溶液加热蒸干
得到白色固体
白色固体成分为纯净的AlCl3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量
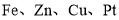 等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述中正确的是(已知氧化性:
等杂质,可用电解法制备高纯度的镍。电解时,下列有关叙述中正确的是(已知氧化性: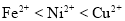 )
)A.阳极发生还原反应,电极反应式:
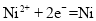
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,电解槽底部的阳极泥中主要有
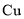 和
和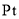
D.电解后,溶液中存在的金属阳离子只有
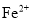 和
和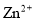
难度: 中等查看答案及解析
-
CO、H2、C2H5OH三种物质燃烧的热化学方程式如下:
①CO(g)+1/2O2(g)═CO2(g) △H1=a kJ/mol;
②H2(g)+1/2O2(g)═H2O(g) △H2=b kJ/mol;
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g) △H3=c kJ/mol。
下列说法正确的是
A.△H1>0
B.2H2O(l)═2H2(g)+O2(g) △H=-2b kJ/mol
C.CO2与H2合成C2H5OH反应的原子利用率为100%
D.2CO(g)+4H2(g)═H2O(g)+C2H5OH(l) △H=(2a+4b-c) kJ/mol
难度: 中等查看答案及解析
-
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是( )
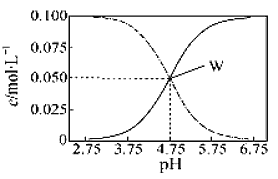
A.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
C.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(忽略溶液体积变化):c(H+)=c(CH3COOH)+c(OH-)
难度: 困难查看答案及解析
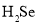 是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
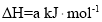
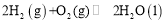
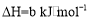
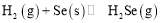 的反应热
的反应热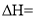 ______
______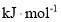 (用含a、b的代数式表示)。
(用含a、b的代数式表示)。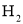 和1molSe,发生反应
和1molSe,发生反应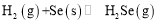 。
。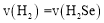
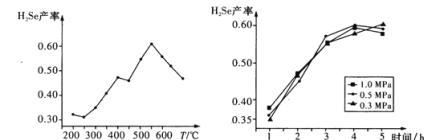
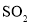 析出硒单质。
析出硒单质。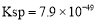 ,CuS的
,CuS的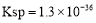 ,则反应
,则反应 的化学平衡常数K=_____(保留2位有效数字)。
的化学平衡常数K=_____(保留2位有效数字)。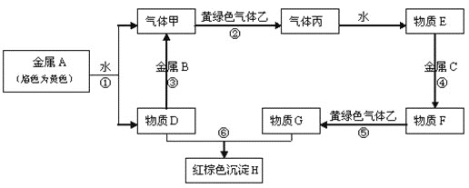
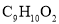 ,试回答下列有关问题。
,试回答下列有关问题。