-
下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列有关该燃料电池的说法正确的是( )
A.在熔融电解质中,O2-移向正极
B.电池总反应式:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是负极,电极反应式为O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应式为C4H10+26e-+13O2-=4CO2+5H2O
难度: 中等查看答案及解析
-
碳铵(NH4HCO3)在室温下就能自发地分解产生氨气,下列有关说法中正确的是:
A.碳铵分解是因为生成了易挥发的气体,使体系的熵增大 B.碳铵分解是因为外界给予了能量
C.碳铵分解是吸热反应,根据焓判据,不能自发分解 D.碳酸盐都不稳定,都能自发分解
难度: 简单查看答案及解析
-
在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)
 N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③ B.③和⑤
C.④和⑤ D.②和④
难度: 简单查看答案及解析
-
已知空气—锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断,锌片是( )
A.正极,被还原 B.正极,被氧化
C.负极,被还原 D.负极,被氧化
难度: 简单查看答案及解析
-
理论上不能设计为原电池的化学反应是,注:△H<0为放热反应
A.CH4(g)+2O2(g)
 CO2(g)+2H2O(l);△H<0
CO2(g)+2H2O(l);△H<0B.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(aq);△H<0
C.2H2(g)+O2(g)
 2H2O(g);△H<0
2H2O(g);△H<0D.2FeCl3(l)+Fe(s)==3FeCl2(l);△H<0
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池可长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O
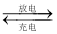 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO
 +4H2O
+4H2OC.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构如图所示。已知总反应为C6H12O6+6O2===6CO2+6H2O,关于该电池的叙述正确的是
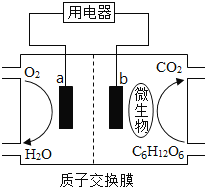
A.a电极反应:O2+2H2O+4e-===4OH-
B.O2在a电极被氧化
C.b电极反应:C6H12O6+6H2O-24e-===6CO2+24H+
D.该电池能够在高温下工作
难度: 中等查看答案及解析
-
如图所示,a、b都是惰性电极,通电一段时间后,b极附近溶液显红色,下列说法中正确的是
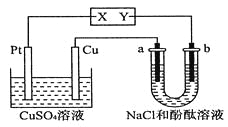
A. X是正极,Y是负极 B. X是负极,Y是正极
C. CuSO4溶液的pH逐渐增大 D. CuSO4溶液的pH保持不变
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.单质的还原性:X >W
B.原子序数:c>b
C.氢化物的稳定性:H2Y>HZ
D.离子半径:X+<W3+
难度: 中等查看答案及解析
-
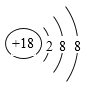
下列化学用语表示正确的是( )
A. 原子核中有6个中子的硼原子:6B
B. HCl的电子式:H+ [:Cl:]—
C. HClO的结构式:H—O—Cl
D. K+ 结构示意图:
难度: 中等查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si

D.人工合成的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
下列结论不正确的是( )
A.微粒半径:K+>Al3+>S2﹣>Cl﹣
B.离子的还原性:Cl﹣<Br﹣<I﹣
C.酸性:H2SO4>H3PO4>H2CO3
D.金属性:K>Ca>Mg>Be
难度: 中等查看答案及解析
-
X、Y是短周期主族元素,常温常压下,两元素形成的单质分别为m、n,m为气态、n为固态,下列推断合理的是( )
A.若X,Y位于IA族,则化合物YX与水反应时水作还原剂
B.若X、Y位于第三周期,则X、Y形成的化合物只含离子键
C.若氢化物还原性HaX<HbY,则单质氧化性m>n
D.若X、Y位于同一主族,则简单离子半径X>Y
难度: 困难查看答案及解析
-
下列说法中不正确的有( )个
①反应速率用于衡量化学反应进行的快慢
②可逆反应达到化学平衡状态时,正、逆反应速率都为0
③决定反应速率的主要因素是反应物的性质
④适当增大反应物浓度,提高反应温度都能增大反应速率
⑤不管什么反应使用催化剂,都可以加快反应速率 ,并可以使平衡移动。
⑥可逆反应A(g)
 B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大
B(g)+C(g),增大压强,正反应速率减小,逆反应速率增大⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大
A.2 个 B.3 个 C.4 个 D.5个
难度: 中等查看答案及解析
-
地震后,抗震救灾要用大量漂白粉和漂白液杀菌消毒。下列叙述中正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水中制取漂白粉
D.漂白液的有效成分是Na2O2
难度: 简单查看答案及解析
-
下列关于臭氧性质的叙述中,不正确的是
A.臭氧比氧气的氧化性更强,常温下能将银、汞等较不活泼的金属氧化
B.臭氧是比氯水更好的消毒剂,因为它在消灭细菌后变成O2,无污染
C.臭氧和活性炭一样,能够吸附有机色素,是种很好的漂白剂
D.臭氧和氧气在一定条件下可以相互转化
难度: 中等查看答案及解析
-
某实验过程如图所示:则图③的试管中的现象是()
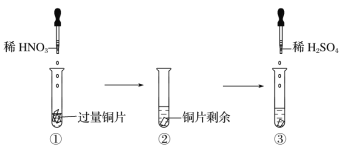
A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体在试管口变为红棕色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体遇到空气不变色
难度: 简单查看答案及解析
-
下列说法正确的是
A.Fe和Mg与0.1mol·L-1的盐酸反应,反应速率相同
B.0.1 mol·L-1的盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同
C.催化剂能降低分子活化时所需能量,使活化分子百分数大大增加
D.100mL2mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
难度: 简单查看答案及解析
-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000 mol·L−1的NaOH溶液
称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取纯净氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
A.A B.B C.C D.D
难度: 中等查看答案及解析
 C(g)。
C(g)。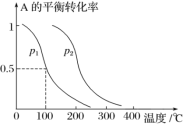
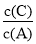 增大的是________。
增大的是________。 bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示: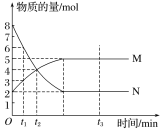
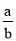 =____________。
=____________。
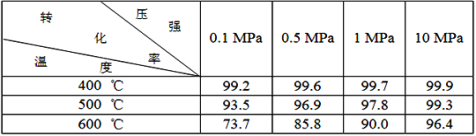
 2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:
2SO3,不同时间点测得密闭体系中三种物质的物质的量如下:
 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。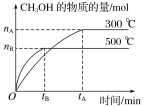
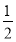 ,在其他条件不变的情况下,对平衡体系产生的影响是____。
,在其他条件不变的情况下,对平衡体系产生的影响是____。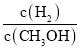 减小
减小 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。 O2(g)=CO(g)ΔH=-111kJ·mol−1
O2(g)=CO(g)ΔH=-111kJ·mol−1