-
下列物质中,属于纯净物的是( )
①陶瓷 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氯水 ⑦液氯
A.①③⑤ B.②④⑥ C.⑤⑦ D.⑥⑦
难度: 中等查看答案及解析
-
化学与生活、生产、科技密切相关。下列说法错误的是( )
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.中国天眼传输信息用的光纤材料是硅
C.研发新能源汽车,减少化石燃料的使用,与“绿水青山就是金山银山”的绿色发展理念一致
D.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.CaCl2的电子式:
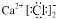 B.Cl-的结构示意图:
B.Cl-的结构示意图: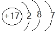
C.乙烯的分子式:C2H4 D.纯碱溶液呈碱性的原因:CO32-+2H2O
 H2CO3+2OH-
H2CO3+2OH-难度: 中等查看答案及解析
-
把各组中的气体通入溶液中,溶液的导电能力显著增强的是( )
A.CO2(g)通入NaOH溶液 B.CO2(g)通入石灰水
C.NH3(g)通入CH3COOH溶液 D.NH3(g)通入盐酸中
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.28gN2与6gH2充分反应,生成NH3分子的数目为2NA
B.6.4gCu与过量S充分反应,转移电子的数目为0.2NA
C.标准状况下,2.24L 三氯甲烷中有分子的数目为0.1NA
D.25°C时,1L pH=1的NaHSO4溶液中含有H+的数目为0.1NA
难度: 简单查看答案及解析
-
某溶液中含有HCO
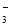 、SO
、SO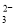 、CO
、CO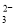 、CH3COO-4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
、CH3COO-4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是A.CH3COO- B.SO
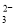 C.CO
C.CO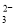 D.HCO
D.HCO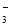
难度: 简单查看答案及解析
-
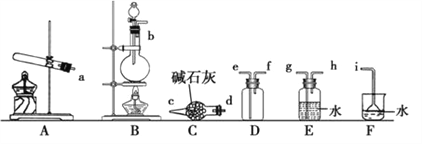
下列有关实验的选项正确的是
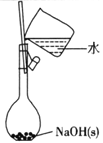
A.配制0.l0mol/L NaOH溶液
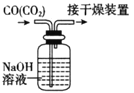
B.除去CO中的CO2
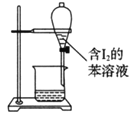
C.苯萃取碘水中的I2,分出水层后的操作
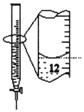
D.记录滴定终点读数为12.20mL
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知异丙苯的结构简式如图,下列说法错误的是( )
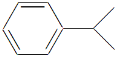
A. 异丙苯中碳原子可能都处于同一平面
B. 异丙苯的沸点比苯高
C. 异丙苯的分子式为C9H12
D. 异丙苯和苯为同系物
难度: 中等查看答案及解析
-
安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e−,可生成标准状况下N2的体积为35.84 L
难度: 困难查看答案及解析
-
如表实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
相同温度下,同时向①4mL0.1mol·L-1KMnO4酸性溶液和②4mL0.2mol·L-1KMnO4酸性溶液中,分别加入4mL1mol·L-1H2C2O4溶液
①中溶液先褪色
该实验条件下,KMnO4浓度越小,反应速率越快
B
向煤炉中灼热的煤炭上洒少量水
产生淡蓝色火焰,煤炭燃烧更旺
加少量水后,可使煤炭燃烧放出更多的热量
C
将苯、液溴和铁粉混合后,将产生的气体先通入CCl4,再通入水中,测所得水溶液的pH
pH<7
证明苯与液溴发生的是取代反应
D
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH
后者较大
证明非金属性
S>C
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的周期序数等于其主族序数,四种元素原子的最外层电子数之和为15,下列叙述正确的是
A.b元素最高价氧化物对应的水化物为强酸
B.最简单气态氢化物的热稳定性:b > c
C.c为第二周期第VIIA族元素
D.原子半径:d > c > b > a
难度: 困难查看答案及解析
-
锂一铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O==2Cu+2Li++2OH-,下列说法不正确的是
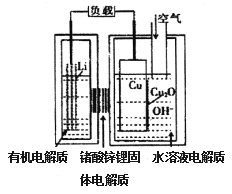
A. 放电时,正极的电极反应式为Cu2O+H2O+2e-=2OH-+2Cu
B. 放电时,电子透过固体电解质向Li极移动
C. 通空气时,铜电极被腐蚀,表面产生Cu2O
D. 整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
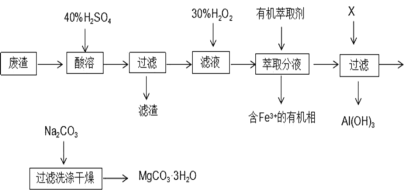
以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:
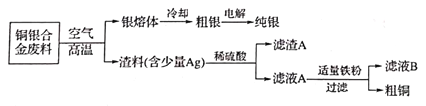
下列说法正确的是
A.粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B.电解时用粗银作阴极,硝酸银溶液为电解质溶液
C.用稀硫酸处理渣料时主要发生了氧化还原反应
D.从滤液B中可以提取绿矾(FeSO4·7H2O)
难度: 中等查看答案及解析
-
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有
A.8种 B.10种 C.12种 D.16种
难度: 困难查看答案及解析
-
25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )
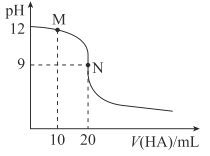
A.应选用酚酞作指示剂
B.M点溶液中存在:c(Na+)>c(A-)
C.Ka(HA)≈2×10-8
D.N点溶液中存在:c(OH-)-c(H+)=c(HA)
难度: 困难查看答案及解析
 CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
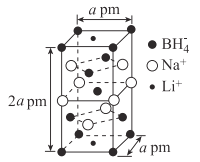
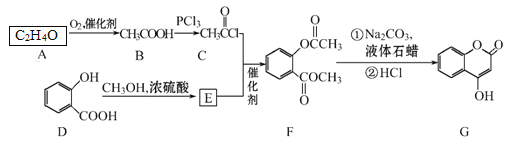
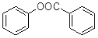 )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____