-
我国古代下列古代发明或技术中,主要原理涉及化学变化的是( )
A.矿石炼铁 B.水车灌溉 C.活字印刷 D.雕刻石像
难度: 简单查看答案及解析
-
儿童每日要摄取适量的钙,才能避免
A.贫血症 B.佝偻病 C.夜盲症 D.甲状腺肿大
难度: 简单查看答案及解析
-
生活中的下列物质,不属于混合物的是
A.干冰 B.空气 C.不锈钢 D.矿泉水
难度: 简单查看答案及解析
-
“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术.下列是某营养液所含的成分,其中属于复合肥料的是( )
A.KCl B.KH2PO4 C.Ca(NO3)2 D.CaSO4
难度: 简单查看答案及解析
-
磷矿粉是常用的磷肥,其化学式为Ca3(PO4)x 。已知磷元素显+5价,式中x的值是
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
某些化学含义可用特定的符号来表示,下列符号表示正确的是
A.2个氮分子 ----2N B.2个亚铁离子----2Fe2+
C.氧化铝中,铝的化合价为+3----
 D.4个氢原子----2H2
D.4个氢原子----2H2难度: 简单查看答案及解析
-
最近科学家用钙原子轰击锫原子,合成117号元素,下列说法不正确的是
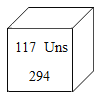
A.钙和锫都属于金属元素 B.该元素的原子序数为117
C.该元素的原子核外电子数为117 D.该元素的相对原子质量为294g
难度: 简单查看答案及解析
-
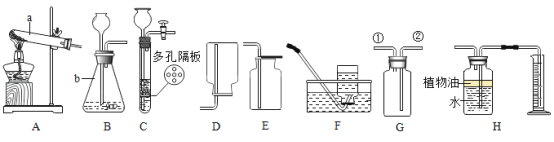
下列实验操作规范的是( )
A.
 量取液体 B.
量取液体 B.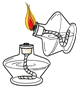 引燃酒精灯
引燃酒精灯C.
 滴加试剂 D.
滴加试剂 D.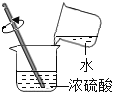 稀浓硫酸
稀浓硫酸难度: 简单查看答案及解析
-
丙烷(C3H8)是液化石油气的主要成分之一,燃烧前后分子种类变化的微观示意图如下。下列说法正确的是( )
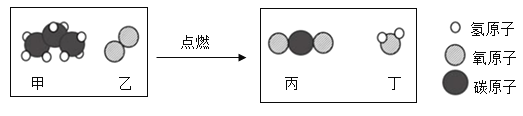
A.甲中碳、氢元素质量比为3:8 B.乙和丙的元素组成相同
C.44g甲完全燃烧至少需160g乙 D.生成的丙与丁的分子个数比为1:1
难度: 中等查看答案及解析
-
食用豆腐能获得人体所需要的多种氨基酸,其中含量最多的是亮氨酸(化学式:C6H13NO2)。下列有关亮氨酸的说法错误的是
A.由四种元素组成 B.亮氨酸中碳元素的质量分数最高
C.一个分子由21个原子构成 D.亮氨酸是有机化合物
难度: 中等查看答案及解析
-
如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是

A.a的溶解度大于b的溶解度
B.P点表示t1℃时a、c两物质溶液溶质的质量分数相等
C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液
D.将t2℃a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:b>a>c
难度: 中等查看答案及解析
-
下列鉴别方法错误的是
A.用点燃丝线的方法鉴别羊绒和化纤
B.用燃着的木条鉴别二氧化碳和氮气
C.用K2CO3溶液鉴别K2SO4和CaCl2溶液
D.用水鉴别Ca(OH)2固体和氧化钙
难度: 中等查看答案及解析
-
在 pH=3的无色水溶液中可能大量存在的离子组是
A.K+、Cu2+ 、Cl- B.K+、SO
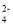 、Ba2+
、Ba2+C.Cl-、Mg2+ 、Na+ D.Cl-、CO
 、Na+
、Na+难度: 中等查看答案及解析
-
在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失。下列说法不正确的是
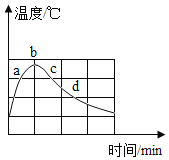
A.NaOH固体溶于水是放热过程 B.a、c两点时,NaOH的溶解度相同
C.b点时,该溶液一定为饱和溶液 D.c点时的溶剂质量等于d点时的溶剂质量
难度: 简单查看答案及解析
-
一定质量的某有机化合物完全燃烧,生成2.2gCO2和1.8gH2O,另取3.2g该有机化合物在O2中完全燃烧,消耗4.8gO2,该有机化合物的化学式可能是
A.C2H4 B.CH4O C.CH4 D.C2H4O
难度: 困难查看答案及解析