-
1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中能量变化如图所示,下列判断错误的是

A.反应物的总能量大于生成物的总能量
B.使用催化剂可降低E1
C.升高温度,活化分子百分数不变
D.热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-(a-c)kJ•mol-1
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.H2(g)、I2(g)、HI(g)平衡体系加压后颜色变深
B.常温下,将pH=10的NH3•H2O溶液稀释10倍,pH>9
C.利用TiC14水解制备TiO2时,需加入大量水并加热
D.向Mg(OH)2悬浊液中滴加FeCl3溶液,有红褐色沉淀生成
难度: 简单查看答案及解析
-
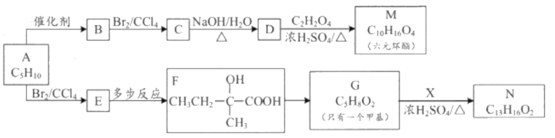
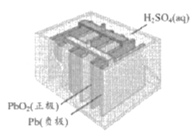
如图为以稀H2SO4为电解质溶液,Pt为电极的氢氧燃料电池的工作原理示意图。下列有关说法错误的是
A.氢氧燃料电池是一种具有应用前景的绿色电源
B.a极为负极,电子由a极经外电路流向b极
C.b极的电极反应式为:O2+4H++4e-=2H2O
D.电池工作一段时间后,装置中c(H2SO4)不变
难度: 简单查看答案及解析
-
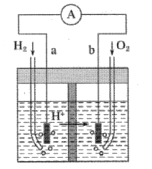
下列电化学装置及用途正确的是
A
B
C
D

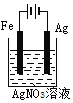

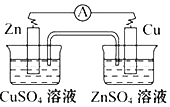
铜的精炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
将0.2 mol/L的KI溶液和0.01mol/L Fe2(SO4)3溶液等体积混合后,取混合液分别进行实验。下列能说明溶液中存在平衡2Fe3++2I-
 2Fe2++I2的是( )
2Fe2++I2的是( )A.滴入硝酸银溶液产生黄色沉淀 B.加入酸性KMnO4溶液,溶液紫红色褪去
C.滴入淀粉溶液,溶液变蓝色 D.滴入KSCN溶液,溶液变红色
难度: 中等查看答案及解析
-
常温下,下列关于pH=3的CH3COOH溶液的叙述错误的是
A.溶液中水电离出的c(H+)=10×10-11mol•L-1
B.与等体积pH=11的NaOH溶液混合,所得溶液pH=7
C.加入少量水稀释该溶液的过程中,
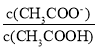 增大
增大D.加入0.1mol•L-1CH3COONa溶液使pH=7,则c(CH3COO-)=c(Na+)
难度: 简单查看答案及解析
-
常温下,进行下列实验操作,能达到预期目的的是
选项
实验操作
实验目的
A
在滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液
证明CO
 在溶液中存在水解平衡
在溶液中存在水解平衡B
分别测定盐酸和醋酸溶液的pH
证明相同温度下,HCl的电离程度大于CH3COOH
C
向0.1mol•L-1的稀硫酸中加入ag锌粉,向0.4mol•L-1的稀硫酸中加入ag锌粒
探究固体表面积对反应速率的影响
D
向两支装有4mL0.0lmol•L-1KMnO4酸性溶液的试管中分别加入2rnL0.04mol•L-1H2C2O4(草酸)溶液、2mL0.2mol•L-1H2C2O4(草酸)溶液
探究浓度对化学反应速率的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
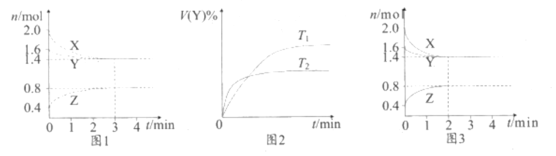

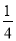 ,W基态原子的价电子排布式为_______。
,W基态原子的价电子排布式为_______。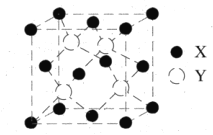
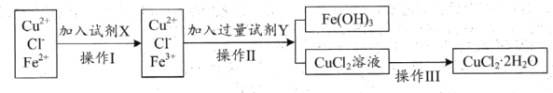
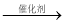 C2H5CH=CH2+CH2=CHCH3
C2H5CH=CH2+CH2=CHCH3