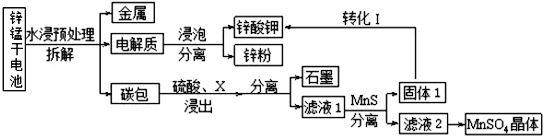
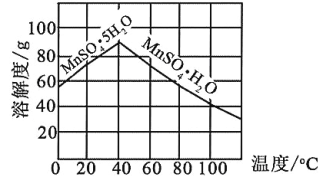
-
对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间
水样
0
5
10
15
20
25
I (pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
II(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
IV(pH=4,含 Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是( )
A. 在0~20 min内,I中M的平均分解速率为0.015mol·L-1·min-1
B. 其它条件相同时,水样酸性越强,M的分解速率越快
C. 在0~25 min内,Ⅲ中M的分解百分率比II大
D. 由于Cu2+存在,IV 中M的分解速率比I快
难度: 困难查看答案及解析
-
甲醛被视为“空气杀手”,可用如下方法检测:5HCHO+4MnO4-+12H+==4Mn2++5CO2+11H2O。下列说法不正确的是
A. 甲醛(HCHO)分子中存在极性键
B. CO2的电子式为:

C. MnO4-是氧化剂,CO2是氧化产物
D. 当有1.8 g甲醛参加反应时,转移电子的物质的量为0.12mol
难度: 中等查看答案及解析
-
下列叙述正确的是
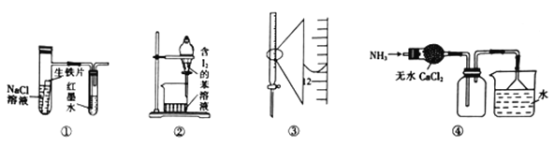
A. 用装置①来验证生铁片发生吸氧腐蚀 B. 用装置②来进行苯萃取碘水中I2的操作
C. 装置③中的读数为12.20 mL D. 用装置④来干燥、收集并吸收多余的氨气
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是
A. pH=3的硫酸溶液中所含H+的数目为10-3 NA
B. 7.8 g Na2O2与足量SO2完全反应,转移的电子数目为0.1 NA
C. 标准状况下,11.2 L丙烷(C3H8)中含有的共用电子对数目为5 NA
D. 0.1 mol NH3与0.1 mol HC1在密闭容器中充分反应后,气体的分子总数为0.1 NA
难度: 中等查看答案及解析
-
向含有下列离子的溶液中加入相应试剂后,发生反应的离子方程式书写正确的是
离子组
加入试剂
离子方程式
A
Al3+、SO42−
适量Ba(OH)2溶液
Al3++3OH−==A1(OH)3↓
B
Fe2+、I−
足量新制氯水
Cl2+2I−==2C1−+I2
C
Fe2+、H+
H2O2溶液
2Fe2++H2O2===2Fe3++O2↑+2H+
D
Ba2+、HCO3−
少量Ba(OH)2溶液
Ba2+ + HCO3−+OH− ==BaCO3↓+H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化合物
 (b)
(b)  (d)、CH
(d)、CH C—CH=CH2(p)的分子式均为C4H4。下列说法正确的是
C—CH=CH2(p)的分子式均为C4H4。下列说法正确的是A. b的同分异构体只有d和p两种 B. d的一氯代物和二氯代物均只有一种
C. b、d、p均可与酸性髙锰酸钾溶液反应 D. 只有b的所有原子处于同一平面
难度: 中等查看答案及解析
-
某固体混合物中可能含有:K+、Na+、Cl-、CO32-、SO42-等离子,将该固体溶解所得到的溶液进行了如下实验:

下列说法正确的是
A. 该混合物一定是K2CO3和NaCl B. 该混合物可能是Na2CO3和KCl
C. 该混合物可能是Na2SO4和Na2CO3 D. 该混合物一定是Na2CO3和NaCl
难度: 中等查看答案及解析
-
向一恒容密闭容器中充入一定量的NO和炭粉,使之发生反应:C(s)+2NO(g)
 CO2(g)+N2(g)ΔH,平衡时c(NO)与温度T的关系如图所示。下列说法正确的是
CO2(g)+N2(g)ΔH,平衡时c(NO)与温度T的关系如图所示。下列说法正确的是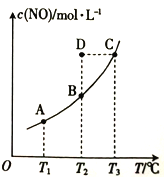
A. ΔH>0
B. T2℃时,D点达到平衡时的平衡常数与B点的相等
C. 正反应速率:v(B)>v(D)>v(A)
D. 温度由T1升高到T3,NO的转化率增大
难度: 困难查看答案及解析
-
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池的总反应方程式如下:2AgCl + Mg === Mg2++ 2Ag +2Cl−。有关该电池的说法正确的是
A. 该电池可用于海上应急照明供电
B. 负极反应式为:AgCl + e− === Ag + Cl−
C. 该电池不能被KCl 溶液激活
D. 电池工作时,每消耗1.2 g Mg,溶液中的Cl-增多0.2 mol
难度: 中等查看答案及解析
-
室温下,向100 mL某浓度H2A溶液中加入0.1 mol·L-1 NaOH溶液,所得溶液的pH随NaOH溶液体积的变化曲线如图所示,其中b、c为等当点(等当点指的是按某个方程式恰好反应的点)。下列有关说法不正确的是
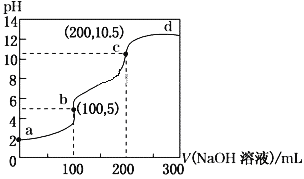
A. 起始时,c(H2A)=0.1 mol·L-1
B. b点时:c(Na+)> c(A2-)>c(HA-) > c(H+)>c(OH-)
C. b→c段,反应的离子方程式为HA-+OH-===A2-+H2O
D. c→d段,溶液中A2-的水解程度逐渐减弱
难度: 中等查看答案及解析
 SO2↑+Cl2↑
SO2↑+Cl2↑ SO2Cl2(l) ΔH = −97.3 kJ·mol-1。催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):
SO2Cl2(l) ΔH = −97.3 kJ·mol-1。催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):
 H2SO4+SO2Cl2,此法得到的产品中混有硫酸。
H2SO4+SO2Cl2,此法得到的产品中混有硫酸。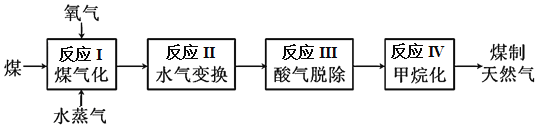
 CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:_________________________。
CO(g) + H2(g) ΔH = +135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:_________________________。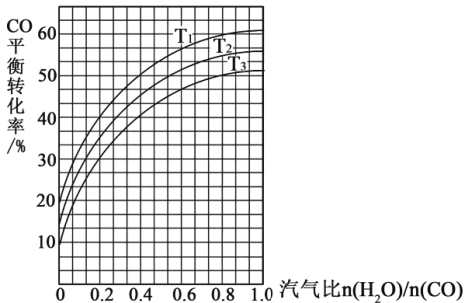
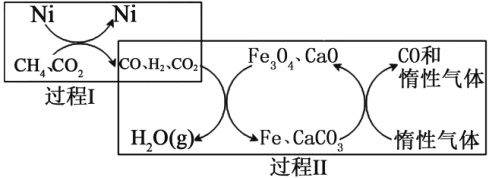
 H>0
H>0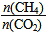 =1,则在过程II中催化剂无法循环使用
=1,则在过程II中催化剂无法循环使用