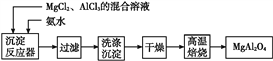
-
下列说法正确的是
①合金的硬度可以大于它的纯金属成分,合金的熔点可以低于它的成分金属
②碘酒、豆浆、牛奶、淀粉溶液都是胶体
③FeO不稳定,在空气里受热就迅速被氧化成Fe2O3
④新型陶瓷、玛瑙、玻璃都不是硅酸盐产品
⑤漂粉精等可用于游泳池的消毒,而有些高级的游泳池则用臭氧等进行消毒
⑥水玻璃、纯碱、氧化钙都是电解质
⑦Ca(HCO3)2、Fe(OH)3、FeCl2都可以用化合反应制得
⑧浓硝酸和浓盐酸按体积比1∶3混合叫做王水,能使一些不溶于硝酸的金属溶解
A. ①⑤⑦⑧ B. ①③⑦⑧ C. ②⑤⑦⑧ D. ③⑥⑦⑧
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A. 左下方区域的金属元素
B. 金属元素和非金属元素分界线附近的元素
C. 右上方区域的非金属元素
D. 稀有气体元素
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 第ⅦA族单质从上往下熔沸点逐渐升高,第ⅠA族单质从上往下熔沸点逐渐降低
B. Na2SiO3溶液可用作矿物胶、木材防火剂,还可用作制备硅胶的原料
C. 品红溶液和滴有酚酞的NaOH溶液均能与SO2气体作用而褪色,且其实质相同
D. 镁和铝性质稳定且都有很强的抗腐蚀能力,所以镁铝合金可用于飞机、轮船制造
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是
A. NaHS溶液中滴加少量的硫酸铜溶液:2HS-+Cu2+═CuS ↓+H2S↑
B. 将NO2气体通入H2O中:3NO2+H2O═2H++NO3-+O2↑
C. ICl和Cl2的化学性质相似,将ICl通入KOH溶液中:ICl+2OH-═I-+ClO-+H2O
D. 1.5 mol·L-1 100 mL的FeBr2溶液中通入3.36 L(标准状况)Cl2:2Br-+Cl2═Br2+2Cl-
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2L三氧化硫中含有分子的数目为0.5NA
B. 用含有0.1mo1FeCl3的饱和溶液配制的氢氧化铁胶体中,胶体粒子数等于0.1NA
C. 1 mol过氧化钠与足量水反应,转移的电子数为NA
D. 1.8g D2O中所含中子数为9NA
难度: 中等查看答案及解析
-
丰富多彩的颜色变化增添了化学实验的魅力,下列反应颜色变化正确的是( )
①新制氯水久置后→浅黄绿色消失 ②Cl2通入石蕊试液中→先变红后褪色
③SO2通入溴水中→橙色褪去 ④浓硫酸滴入蔗糖晶体中→先变黄后变黑色
⑤氨气通入酚酞溶液中→变红色
A. ①②④⑤ B. ②③④⑤ C. ①②③④ D. 全部
难度: 中等查看答案及解析
-
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M元素的原子是短周期中原子半径最大的。下列说法正确的是
A. X、Z、W三元素形成的化合物都是共价化合物
B. 简单离子的半径从大到小的顺序是:M>Y>Z>W
C. 氢化物的稳定性强弱顺序为:Y>Z>W
D. M2W2既含有离子键,也含有非极性键
难度: 中等查看答案及解析
-
W、Q、X、Y、Z是五种短周期主族元素,其中X原子K、L层电子数之比为1∶2,Y元素最外层电子数是次外层的3倍,Z是短周期主族元素中原子半径最大的元素,W是地壳中含量最高的金属元素, Q元素最高化合价与最低化合价之和为6。下列判断正确的是
A. W、Q、X、Y、Z的原子序数依次递增
B. Y的简单氢化物比X的稳定性高
C. 常温下,W元素的单质与浓硝酸反应生成NO2
D. Z、W的单质分别与Q的单质化合后的产物中所含化学键类型相同
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 足量的Fe在Cl2中燃烧只生成FeCl3
B. 铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C. 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
D. 向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液只含Fe2+
难度: 中等查看答案及解析
-
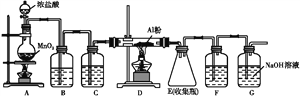
根据下列装置完成系列实验,下列说法正确的是( )
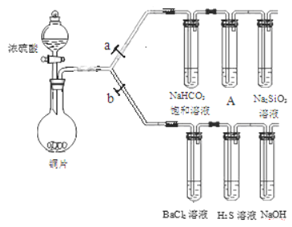
A. 铜和浓硝酸的反应与铜和浓硫酸的反应一样需要加热条件下才能进行
B. BaCl2溶液中会出现白色沉淀BaSO3
C. H2S溶液中会出现黄色沉淀,体现了SO2的还原性
D. 为验证碳、硅非金属性的相对强弱,A试管中的试剂可以是KMnO4溶液
难度: 中等查看答案及解析
-
下列化学用语表述正确的是( )
A. 核内质子数为117、中子数为174的核素Ts可表示为:

B. 氯离子的结构示意图:
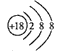
C. COCl2的结构式为:
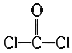
D. CaO2的电子式为:

难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+xNa2O+16N2↑,下列说法错误的是
A.x=5
B.每生成16 mol N2转移10 mol电子
C.N2既是氧化产物又是还原产物
D.反应中氧化产物与还原产物的质量之比为15:1
难度: 困难查看答案及解析
-
下列反应中,反应后固体物质质量不变的是
A. 在试管中加热小苏打粉末 B. 铝丝插入Cu(NO3)2溶液中
C. 在O2中灼烧Cu2S使之转化为CuO D. 水蒸气通过高温炽热的铁粉
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能溶解Al2O3的溶液中:Na+、Fe2+、ClO-、SO42-
B. 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C. 含有Na2SO3的溶液中:K+、H+、Cl-、NO3-
D. 由水电离产生的c(OH-)=l×10-10mol·L-1的溶液中:Ba2+、K+、NO3-、Br-
难度: 中等查看答案及解析
-
下列图象能正确表示相关反应中产物物质的量的变化的是( )
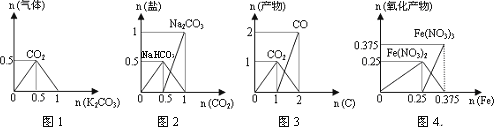
(横、纵坐标单位:mol)
A. 图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B. 图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐
C. 图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D. 图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
难度: 简单查看答案及解析
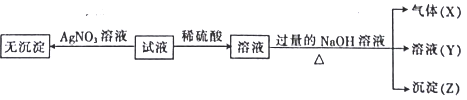

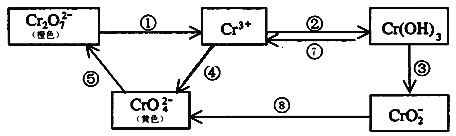
 离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;