-
水是生命之源,生产生活都离不开水。下列有关说法正确的是
A.水是一种非电解质 B.水的电离是放热过程
C.纯水的pH一定等于7 D.纯水中c(H+)=c(OH-)
难度: 简单查看答案及解析
-
下列说法中错误的是
A.原电池在工作时将化学能转化为电能
B.煤燃烧时将化学能全部转化为热能
C.下图所示的化学反应属于放热反应
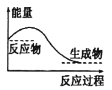
D.化学键的断裂与生成是化学反应中能量变化的根本原因
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.加入合适的催化剂,可使平衡正向移动
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成n mol NO,同时消耗n mol NH3,则反应达到平衡状态
难度: 简单查看答案及解析
-
常温下,下列各种溶液中,可能大量共存的离子组是
A.
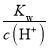 =10-10 mol·L-1的溶液中:
=10-10 mol·L-1的溶液中: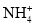 、I-、Cl-、K+
、I-、Cl-、K+B.c(H+)=10-14 mol·L-1的溶液中:Mg2+、
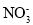 、Fe2+、ClO-
、Fe2+、ClO-C.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:
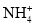 、
、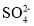 、
、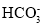 、Cl-
、Cl-D.使酚酞变红色的溶液:Na+、Cu2+、
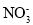 、Cl-
、Cl-难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Na2S溶液中S2-的水解:S2-+2H2O=H2S↑+2OH-
B.HS-的电离方程式:HS-+H2O
 S2-+H3O+
S2-+H3O+C.H3PO4的电离方程式:H3PO4
 3H++
3H++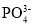
D.用石墨作电极电解NaCl溶液:2Cl-+2H+
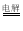 Cl2↑+H2↑
Cl2↑+H2↑难度: 中等查看答案及解析
-
以下反应均可制取O2。下列有关说法正确的是
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
A.制取O2的反应一定是吸热反应
B.H2的燃烧热为-571.6 kJ·mol-1
C.若使用催化剂,反应②的△H将减小
D.反应2H2O2(l)=2H2O(g)+O2(g)的△H>-196.4 kJ·mol-1
难度: 中等查看答案及解析
-
下列不能用勒夏特列原理解释的事实是
A.加入催化剂可以提高单位时间氨的产量
B.高压比常压有利于合成氨的反应
C.用热的纯碱溶液洗油污时,去污效果好
D.工业生产硫酸的过程中,通入过量的空气以提高SO2的转化率
难度: 简单查看答案及解析
-
某华人科学家和他的团队研发出“纸电池”(如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为:Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2+2H2O+2e-=2MnO(OH)+2OH-
D.当有0.1 mol锌溶解时,转移的电子数为0.4×6.02×1023
难度: 中等查看答案及解析
-
下列说法正确的是
A.升高温度,反应速度加快,主要原因是活化分子的百分数增加
B.用酶作催化剂的反应,温度越高,化学反应速率一定越快
C.为减缓浸入海水中的钢铁水闸的腐蚀,可在其表面镶上铜锭
D.电解法精炼铜时,应将粗铜板做阴极
难度: 中等查看答案及解析
-
对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
A.0.1 mol·L-1氨水,溶液的pH=13
B.向0.1 mol·L-1氨水中加入少量水,溶液中
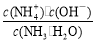 增大
增大C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.向0.1 mol·L-1醋酸中加入少量水,醋酸电离平衡正向移动
难度: 中等查看答案及解析
-
下列说法正确的是
A.室温时,用广泛pH试纸测得某溶液pH为2.3
B.将AlCl3、Al2(SO4)3溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体成分相同
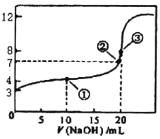
C.用标准盐酸滴定未知浓度的NaOH溶液,滴定前酸式滴定管尖嘴有气泡未排出,滴定后气泡消失,会造成测定结果偏低
D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
难度: 中等查看答案及解析
-
在2L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
 M(g),数据如下:
M(g),数据如下:实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
800
0.10
0.40
0.080
②
800
0.20
0.80
a
③
900
0.10
0.15
0.06
下列说法正确的是
A.实验①5min达平衡,平均反应速率v(X)=0.016 mol/(L·min)
B.实验①中,该反应的平衡常数K=1
C.实验②中,达到平衡时,a小于0.16
D.正反应为吸热反应
难度: 中等查看答案及解析
 2NH3(g) △H=a kJ·mol-1,能量变化如图所示:
2NH3(g) △H=a kJ·mol-1,能量变化如图所示: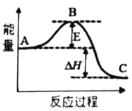
 2CO(g)+2H2(g)△H=+247.0 kJ·mol-1。在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下发生反应,CO2的平衡转化率如下表所示:
2CO(g)+2H2(g)△H=+247.0 kJ·mol-1。在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下发生反应,CO2的平衡转化率如下表所示: 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。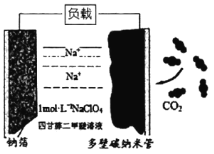
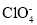 流向_____(填“钠箔”或“多壁碳纳米管”)电极。
流向_____(填“钠箔”或“多壁碳纳米管”)电极。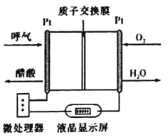
 N2(g)+2CO2(g) △H<0。
N2(g)+2CO2(g) △H<0。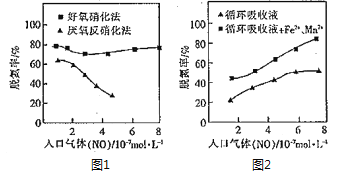
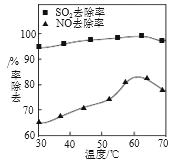
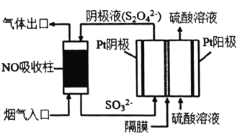
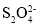 )为还原剂脱除烟气中的NO,并通过电解再生,装置如下图,阴极的电极反应式为_______。
)为还原剂脱除烟气中的NO,并通过电解再生,装置如下图,阴极的电极反应式为_______。