-
向下列物质的水溶液中加入AgNO3,有白色沉淀产生的是( )
A.CH3Cl B.NaCl C.KClO3 D.CCl4
难度: 简单查看答案及解析
-
鲍林被认为是20世纪对化学科学影响最大的人之一,他也是两位获得诺贝尔奖不同奖项的人之一。杂化轨道是鲍林为了解释分子的立体构型提出的,下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )
A.sp杂化轨道的夹角最大
B.sp2杂化轨道的夹角最大
C.sp3杂化轨道的夹角最大
D.sp3、sp2、sp杂化轨道的夹角相等
难度: 简单查看答案及解析
-
人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是
A.1s22s22p63s23p6 B.1s22s22p63s23p63d54s2
C.1s22s22p63s23p63d54s1 D.1s22s22p63s23p63d104s1
难度: 简单查看答案及解析
-
CH3CH(C2H5)CH(C2H5)CH(CH3)2的名称是( )
A. 2,3-二甲基-4-乙基戊烷
B. 2-甲基-3,4-二乙基戊烷
C. 2,5-二甲基-3-乙基己烷
D. 2,4-二甲基-3-乙基己烷
难度: 中等查看答案及解析
-
了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子成键方式的描述不正确的是( )
A.烷烃分子中碳原子均采取sp3杂化成键
B.炔烃分子中的碳碳三键由1个σ键、2个π键组成
C.苯分子中所有碳原子均采取sp2杂化成键,苯环中存在6个碳原子共有的大π键
D.甲苯分子中所有碳原子均采取sp2杂化成键
难度: 简单查看答案及解析
-
据报道,大气中存在一种潜在的温室气体SF5-CF3,下列关于SF5-CF3的说法正确的是( )
A.分子中既有σ键也有π键
B.所有原子在同一平面内
C.分子中并非所有原子均满足8电子稳定结构
D.0.1 mol SF5-CF3分子中含8 mol电子
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.用银氨溶液检验某病人是否患糖尿病
B.酶不属于蛋白质
C.在植物油中滴入溴水,溴水褪色
D.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
难度: 简单查看答案及解析
-
下列说法中错误的是
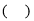
A.根据对角线规则,铍和铝的性质具有相似性
B.在
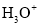 、
、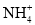 和
和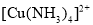 中都存在配位键
中都存在配位键C.元素电负性越大的原子,吸引电子的能力越强
D.
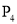 和
和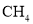 都是正四面体分子且键角都为
都是正四面体分子且键角都为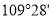
难度: 中等查看答案及解析
-
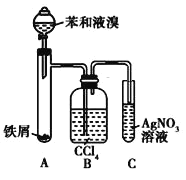
下列实验操作顺序或方法正确的是
A.把苯和浓溴水混合后加入FeBr3可制溴苯
B.浓硫酸与浓硝酸混合冷却后,边滴入苯边振荡,在60℃水浴中加热可制硝基苯
C.乙烷中混有乙烯,通入氢气与乙烯反应可达到除杂的目的
D.乙烯通入水中可制得酒精
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.乙硫醇(CH3CH2—SH)比乙醇(CH3CH2—OH)熔点低原因是乙醇分子间易形成氢键
B.氯化钠易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 简单查看答案及解析
-
现代无机化学对硫—氮化合物的研究是最为活跃的领域之一。其中如图所示是已合成的最著名的硫—氮化合物的分子结构。下列说法正确的是( )
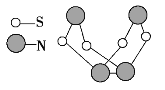
A.该物质的分子式为SN B.该物质的分子中既有极性键,又有非极性键
C.该物质在固态时形成原子晶体 D.该物质与化合物S2N2互为同素异形体
难度: 简单查看答案及解析
-
分子式为C4H8Cl2的有机物共有(不含立体异构)
A.7种 B.8种 C.9种 D.10种
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.CS2为V形的极性分子,形成分子晶体
B.
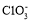 的空间构型为平面三角形
的空间构型为平面三角形C.氯化硼BCl3的熔点为-107 ℃,氯化硼液态时能导电而固态时不导电
D.SiF4和
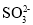 的中心原子均为sp3杂化,SiF4分子呈空间正四面体,
的中心原子均为sp3杂化,SiF4分子呈空间正四面体,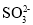 呈三角锥形
呈三角锥形难度: 简单查看答案及解析
-
为了鉴别某白色纺织品的成分是真蚕丝还是“人造丝”,可选用的方法是( )
A.滴加浓硝酸 B.滴加浓硫酸 C.滴加酒精 D.灼烧
难度: 简单查看答案及解析
-
物质结构理论推出,金属晶体中金属离子与自由电子之间强烈的相互作用,叫金属键。金属键越强,其金属的硬度越大,熔沸点越高。据研究表明,一般说来,金属原子半径越小,价电子数越多,则金属键越强。由此判断下列说法错误的是( )
A.镁的硬度小于铝 B.镁的熔沸点低于钙
C.镁的硬度大于钾 D.钙的熔沸点高于钾
难度: 简单查看答案及解析
-
向淀粉中加入少量稀H2SO4,并加热使之发生水解反应,为测定水解的程度,需下列试剂中的 ①氢氧化钠溶液 ②银氨溶液 ③新制氢氧化铜 ④碘水 ⑤氯化钡溶液( )
A.①⑤ B.②④ C.①③④ D.②③④
难度: 简单查看答案及解析
-
下列离子的VSEPR模型与其立体构型一致的是( )
A.
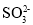 B.
B.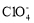 C.
C.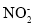 D.
D.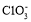
难度: 简单查看答案及解析
-
下面有关晶体的叙述中,错误的是
A.白磷晶体中,分子之间通过共价键结合
B.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
C.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-或(Na+)
D.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
难度: 中等查看答案及解析
-
能说明苯分子中无碳碳双键的事实是 ( )
A.苯燃烧产生明亮的火焰和浓烟 B.苯不能使酸性高锰酸钾溶液褪色
C.苯可以有些物质发生取代反应 D.苯与氢气在一定条件下能发生反应
难度: 简单查看答案及解析
-
一种气态烷烃和气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加8.4g,该混合气体是
A.乙烯和乙烷 B.甲烷和乙烯
C.丙烯和甲烷 D.丙烯和乙烷
难度: 困难查看答案及解析
-
下列说法中正确的是( )
I1
I2
I3
I4
I5
I6
I7
578
1 817
2 745
11 575
14 830
18 376
23 293
A.HF、HCl、H2S、PH3的稳定性依次增强
B.在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
C.某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
D.按Mg、Si、N、F的顺序,原子半径由小变大
难度: 简单查看答案及解析
-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构) ( )
A.7种 B.6种 C.5种 D.4种
难度: 简单查看答案及解析
-
下列有关说法不正确的是( )
A.
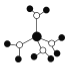 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键B.
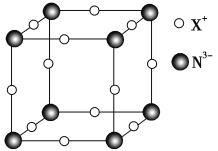
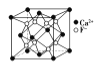 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+C.
 H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动D.
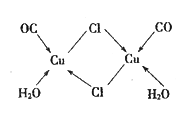
 金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12难度: 简单查看答案及解析
-
下列排序正确的是( )
A.沸点:PH3<NH3<H2O B.碱性:Ba(OH)2<Ca(OH)2<KOH
C.熔点:MgBr2<SiCl4<BN D.酸性:H2CO3<C6H5OH<CH3COOH
难度: 中等查看答案及解析
-
碳化硅(SiC)晶体有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。它与晶体硅和金刚石相比较,正确的是( )
A.熔点从高到低的顺序是碳化硅>金刚石>晶体硅
B.熔点从高到低的顺序是金刚石>晶体硅>碳化硅
C.三种晶体中的单元都是正四面体结构
D.三种晶体都是原子晶体且均为电的绝缘体
难度: 简单查看答案及解析
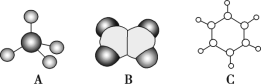
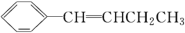 的有机物中处于同一平面内的碳原子最多有_______个。
的有机物中处于同一平面内的碳原子最多有_______个。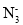 。请写出两种与
。请写出两种与