-
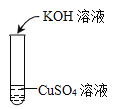
运输下列物质时,应张贴“腐蚀品”标识的是( )

A.氢氧化钠 B.汽油 C.铁矿石 D.大理石
难度: 简单查看答案及解析
-
下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A.
 B.
B.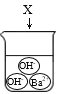 C.
C.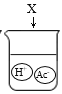 D.
D.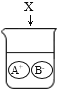
难度: 中等查看答案及解析
-
下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
难度: 中等查看答案及解析
-
下列物质不能与盐酸反应的是( )
A. Mg B. AgNO3 C. Cu(OH)2 D. FeSO4
难度: 中等查看答案及解析
-
为研究盐酸的化学性质,小明进行如下实验。其中能产生白色沉淀的是( )
A.
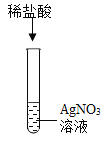 B.
B.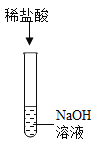 C.
C.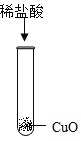 D.
D.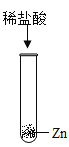
难度: 简单查看答案及解析
-
(2019杭州)在①氧化铁②金属锌③氢氧化铜④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )
A.①②③④ B.①②③
C.①③④ D.②③④
难度: 简单查看答案及解析
-
下列有关氢氧化钾的说法正确的是
A.氢氧化钾固体露置在空气中易变质
B.氢氧化钾溶液能使石蕊溶液变红
C.氢氧化钾溶液与氧化铜反应生成蓝色沉淀
D.2mL氢氧化钾溶液与1mL硫酸溶液恰好完全反应
难度: 简单查看答案及解析
-
能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是( )
A. HCl B. KNO3 C. K2CO3 D. FeCl3
难度: 简单查看答案及解析
-
取碳酸钾、碳酸镁和碳酸锌的固体混合物7.5g,加入到100g7.3%的稀盐酸中,充分反应后,蒸干溶液得到8.27g固体。则原混合物中金属元素的质量分数为
A.50%
B.44%
C.35%
D.12.9%
难度: 困难查看答案及解析
-
中和反应在工农业生产和日常生活中有广泛的应用。下列应用符合中和反应原理的是( )
A.蚊虫叮咬分泌的蚁酸可涂抹稀氨水消除
B.用熟石灰检验铵态氮肥
C.用硫酸铜和石灰乳配制农药波尔多液
D.用稀盐酸洗净久置石灰水试剂瓶瓶口上的白色固体
难度: 简单查看答案及解析
-
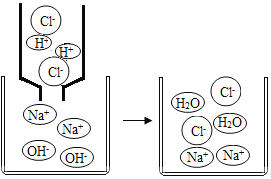
在氢氧化钠溶液中加入盐酸,至恰好完全反应,反应的微观示意图如右图所示。下列有关认识错误的是
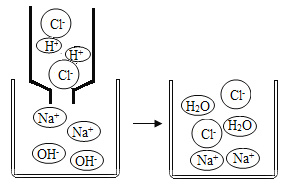
A.反应结束时溶液的pH=7
B.反应前后元素的种类没有变化
C.发生了中和反应
D.该微观图还可说明所有物质都是由分子构成的
难度: 中等查看答案及解析
-
等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )
A.所用氢氧化钠溶液和稀盐酸的溶质质量分数相等
B.混合溶液中钠离子与氯离子个数相等
C.混合前后水分子总数不变
D.混合前后阳离子总数不变
难度: 简单查看答案及解析
-
室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化),下列分析正确的是( )
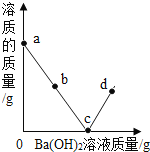
A.a点溶液中有两种溶质
B.b点溶液中滴加紫色石蕊溶液,溶液变蓝
C.c点烧杯内液体的pH=7
D.d点溶液中有较多的Ba2+、OH-、SO
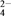 、H+
、H+难度: 困难查看答案及解析
-
(2019上海)能使紫色石蕊试液变蓝的是( )
A.水 B.石灰水
C.稀硫酸 D.稀盐酸
难度: 简单查看答案及解析
-
(2019北京)一些食物的pH范围如下,其中呈碱性的是( )
A.柠檬汁(2.0~3.0) B.番茄汁(4.0~4.4)
C.牛奶(6.3~6.6) D.鸡蛋清(7.6~8.0)
难度: 简单查看答案及解析
-
下列有关溶液酸碱性的说法错误的是( )
A. pH=7的溶液呈中性
B. pH>7的溶液一定呈碱性
C. pH<7的雨水一定是酸雨
D. 酸溶液的pH越小酸性越强
难度: 中等查看答案及解析
-
一些物质的近似pH如图,下列有关说法正确的是( )

A.苹果汁的酸性比纯鲜牛奶的酸性弱。
B.肥皂水的碱性比炉具清洁剂的碱性强
C.厕所清洁剂与炉具清洁剂能混用
D.人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒
难度: 简单查看答案及解析


 2NaOH+Cl2↑+X↑。X的化学式为_____。
2NaOH+Cl2↑+X↑。X的化学式为_____。 第16题图1
第16题图1