-
生活中下列处理方法正确的是
A. 蚂蚁叮咬的红肿处涂沫苯酚止痒 B. 冬天在汽车水箱中加乙二醇抗冻
C. 纺织品上的油腻用烧碱溶液清洗 D. 把铁器具浸入水隔绝空气防生锈
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 9g超重水(3H216O)含中子数为6NA
B. 标准状况下,22.4L CCl4含有的分子数目为NA
C. 78g过氧化钠中含有的阴阳离子总数为4NA
D. 28g乙烯与聚乙烯的混合物完全燃烧生成水的分子数为2NA
难度: 简单查看答案及解析
-
某有机化合物的结构简式为
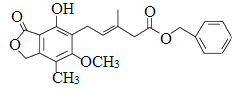 ,下列关于该化合物的说法不正确的是
,下列关于该化合物的说法不正确的是A. 该有机物的分子式为C23H24O6
B. 1mol该化合物最多可以与9molH2发生加成反应
C. 既可以使溴的四氯化碳溶液褪色,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应
难度: 困难查看答案及解析
-
对下列实验现象解释正确的是
实验内容
实验现象
相关解释
A
等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应
浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色
c(Cu2+)不同
B
NH3与Cl2混合
生成白烟
NH3与Cl2发生化合反应生成NH4Cl
C
往Fe(OH)3胶体中逐滴滴入稀盐酸
先出现红褐色沉淀,后沉淀溶解
先胶体聚沉,后Fe(OH)3溶解
D
加热硝酸铜固体,将带火星的木条伸入所得的气体中
生成红棕色气体,带火星木条复燃
2Cu(NO3)2
 2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性。
2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性。A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知高能锂离子电池的总反应式为2Li+FeS
 Fe+Li2S,LiPF6·SO( CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是
Fe+Li2S,LiPF6·SO( CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是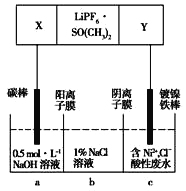
A. 电极Y应为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-
 Fe+Li2S
Fe+Li2SD. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
难度: 中等查看答案及解析
-
短周期元素a、b、c、d的原子序数依次增大,由以上四种元素组成的一种化合物m在加热时完全分解为三种产物,其中一种产物n 是能使湿润的红色石蕊试纸变蓝的气体,另一种产物q是无色无味的能使澄清石灰水变浑浊的气体。下列说法正确的是
A. 原了半径:a<b<c<d
B. b、c、d 的简单氢化物的热稳定性依次增强
C. a、c、d 三种元素形成的化合物一定会抑制水的电离
D. m、n、q三种物质中只含共价键
难度: 中等查看答案及解析
-
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是
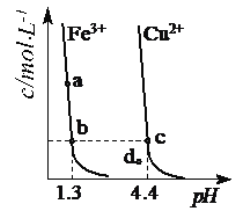
A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等
难度: 困难查看答案及解析
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1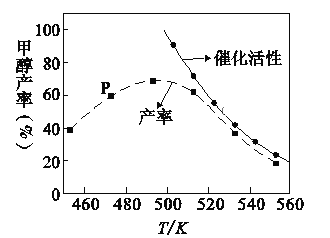
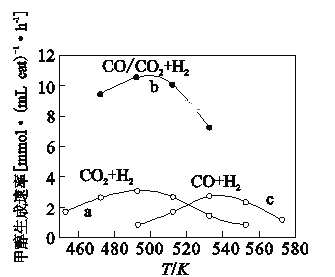
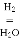 CO
CO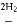 CH3OH II.CO
CH3OH II.CO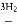 CH3OH+H2O
CH3OH+H2O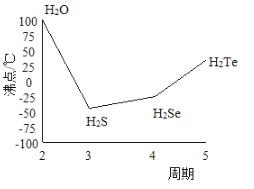
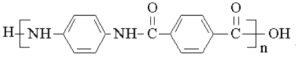 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: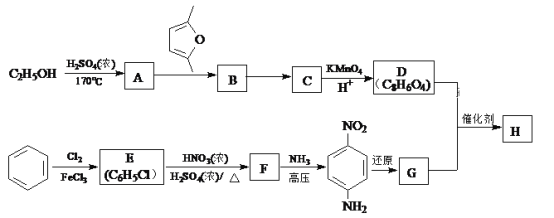
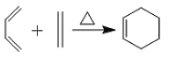 。
。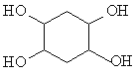 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。