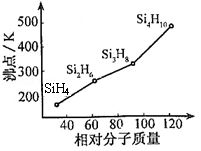
-
下列说法正确的是
A.双氧水、高锰酸钾溶液可以完全灭活埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理相同
B.不法商家制取的“地沟油”具有固定的熔沸点
C.食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等,PVC的单体可由PE的单体与氯化氢加成制得
D.乙醇用作医用消毒剂时,无水乙醇消毒效果最好
难度: 中等查看答案及解析
-
下列说法正确的是
A.NA个Fe(OH)3胶体粒子的质量为107g
B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
C.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA
D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
难度: 中等查看答案及解析
-
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)= 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-= Na
B.盖·吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1
D.工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
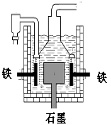
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍或者是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是
A.元素A所形成的氧化物只有一种
B.元素B的最高价氧化物对应的水化物为强酸
C.元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应
D.氢化物的稳定性:A>B
难度: 中等查看答案及解析
-
常温下,在10mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.当溶液的pH为7时,溶液的总体积为20 mL
C.在B点所示的溶液中,浓度最大的阳离子是Na+
D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是
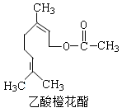
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③它的同分异构体中有芳香族化合物
④1mol该有机物水解时只能消耗1molNaOH
⑤1mol该有机物在一定条件下能和3mol H2反应
A.①②③ B.①②④ C.①②⑤ D.①②③④
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现 象
解 释
A
KI淀粉溶液中通入Cl2,溶液变蓝
Cl2能与淀粉发生显色反应
B
向盐酸中加入浓硫酸时产生白雾
说明浓硫酸具有脱水性
C
某溶液中加入硝酸酸化的氯化钡
溶液,有白色沉淀生成
说明该溶液中含有SO42-
D
浓HNO3在光照条件下变黄
浓HNO3不稳定,生成棕色NO2能溶于浓硝酸
难度: 中等查看答案及解析


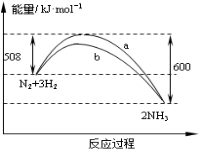
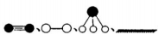 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用下图表示: