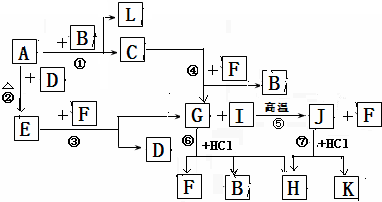
-
下列各组离子在溶液中不能大量共存,且加入过量NaOH溶液或过量稀盐酸均能得到澄清溶液的是( )
A.Fe3+、Cl-、Na+、SO42-
B.Al3+、Na+、CO32-、NO3-
C.Ag+、Na+、SO42-、NO3-
D.AlO2-、CO32-、K+、Na+难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.含有等物质的量的氢氧化钡、明矾两种溶液混合:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.溴化亚铁与足量氯气反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.H2O中投入Na2O2固体:2H2O+2O22-=4OH-+O2↑
D.在碳酸氢钙溶液中加入过量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O难度: 中等查看答案及解析
-
含Ba(OH)2 17.1g的稀溶液与足量稀盐酸反应,放出11.46KJ热,表示该反应中和热的化学方程式正确的是( )
A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)△H=-114.6KJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)△H=+114.6KJ/mol
C.1/2Ba(OH)2(aq)+HCl(aq)=1/2BaCl2(aq)+H2O(g)△H=-57.3KJ/mol
D.1/2Ba(OH)2(aq)+HCl(aq)=1/2BaCl2(aq)+H2O(l)△H=+57.3KJ/mol难度: 中等查看答案及解析
-
已知某溶液中存在OH+、H+、NH4+、Cl- 四种离子.经四位同学测定,其大小关系如下,则其中不可能的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)=c(NH4+)
C.c(OH-)>c(H+)>c(Cl-)>c(NH4+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)难度: 中等查看答案及解析
-
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是( )
①原气体中肯定有SO2,②原气体中可能有SO2,③原气体中肯定没有H2S、HBr,④不能肯定原气体中是否含有HCl,⑤原气体中肯定无CO2,⑥原气体中肯定有HCl.
A.①③④
B.②④
C.①③⑥
D.①③⑤⑥难度: 中等查看答案及解析
-
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA难度: 中等查看答案及解析
-
下列说法不正确的是( )

A.可用该图装置吸收氨气
B.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C.光线透过胶体时,胶体发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体
D.分散质粒子在1nm-100nm之间的分散系称为胶体,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过难度: 中等查看答案及解析
-
据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点.其电池反应为:2Zn+O2=2ZnO,原料为锌、空气和电解质溶液,则下列叙述正确的是( )
A.锌为正极,空气在负极反应
B.负极的电极反应为:Zn-2e-+2OH-═ZnO+H2O
C.OH-在电解质溶液中向正极移动
D.电池工作时溶液的pH 降低难度: 中等查看答案及解析
-
可逆反应A(g)+B⇌C(g)+D,达到平衡时,下列说法不正确的是( )
A.若B是气体,增大A的浓度会使B转化率增大
B.若增大A的浓度,平衡体系颜色加深,则D是有颜色的气体
C.升高温度,C百分含量减少,说明正反应是放热反应
D.增大压强,平衡不移动,说明B、D有可能是非气态难度: 中等查看答案及解析
-
在密闭容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)
2C(g);
△H<0.达到平衡后,改变一个条件(X),下列量(Y)的变化一定符合图中曲线的是( )X Y A 再加入A B的转化率 B 再加入C A的转化率 C 增大压强 A的质量分数 D 升高温度 混合气体平均摩尔质量
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在Na2HPO4溶液中,存在着下列平衡:HPO42-⇌H++PO43-,HPO42-+H2O⇌H2PO4-+OH-,并且溶液呈碱性.欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
A.加盐酸
B.加石灰水
C.加烧碱
D.用水稀释难度: 中等查看答案及解析
-
下列操作或仪器的选用正确的是( )
A.
滴定FeSO4
B.
制取O2
C.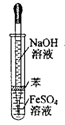
制备Fe(OH)2
D.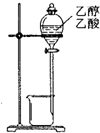
除去乙醇中的乙酸难度: 中等查看答案及解析