-
“化学,让生活更美好”,下列说法不能直接体现这一主旨的是
A.风力发电,让能源更清洁 B.合成光纤,让通讯更快捷
C.合成药物,让人类更健康 D.环保涂料,让环境更宜居
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应放热还是吸热必须看反应物和生成物既有的总能量的相对大小
D.已知石墨(s)比金刚石(s)稳定,则石墨(s)转化为金刚石(s)要放出能量
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大
于吸热反应的反应速率
C.根据盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是

难度: 中等查看答案及解析
-
某反应由两步反应A
B
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是
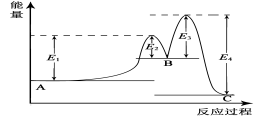
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应中ΔH=E1-E4
难度: 中等查看答案及解析
-
在可逆反应2A(g)+3B(g)
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5mol·L-1·min-1。2 min末,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是
A.2 min末时A和B的浓度之比为5∶3 B.x=1
C.前2 min,A的消耗
浓度为0.5 mol·L-1 D.2 min末时B的浓度为1.5 mol·L-1
难度: 中等查看答案及解析
-
下列各组热化学方程式中,△H1>△H2的是( )
①C
(s)+O2(g)=CO2(g)△H1 C(s)+1/2O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H1 S(g)+O2(g)=SO2(g)△H2
③H2(g)+1/2O2(g)=H2O(l)△H1 2H2(g)+O2(g)=2H2O(l)△H2
④CaO(s)+H2O(l)=Ca(OH)2(s)△H1 CaCO3(s)=CaO(s)+CO2(g)△H2
A.①④ B.②③ C. ②④ D.①③
难度: 中等查看答案及解析
-
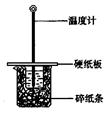
为提高中和热测定的准确性,下列措施不合理的是
A.用两只量筒分别量取所需氢氧化钠和盐酸
B.两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度
C.仪器装置保温隔热的效果要好,且操作动作要迅速
D.所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等
难度: 简单查看答案及解析
-
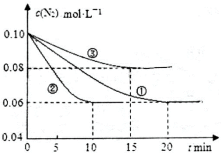
在2L密闭
容器中,加入X和Y各4mol,一定条件下发生化学反应:
2X(g)+ 2Y(g)
Z(g) + 2 W(g) △H <0, 反应进行到5s时达到化学平衡,测得X的转化率为25%,则下列说法正确的是
A.5s时,正、逆反应速率都达到最大
B.前5s
内平均反应速率υ(Y)= 0.1 mol/( L·s)
C.达平衡时,各物质的浓度都保持不变,反应停止
D.升高温度,测得容器中密度不变时,表示该反应已经达到平衡状态
难度: 中等查看答案及解析
-
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是
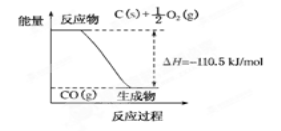
A.12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g);ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
难度: 中等查看答案及解析
-
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2 、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)
2SO2(g)+O2(g);△H =+196.6 kJ/mol
B.2SO2(g)+O2(g)
SO3(g);△H =-98.3 kJ/mol
C.SO2(g)+1/2O2(g)
SO3(g);△H=+98.3 kJ/mol
D.SO2(g)+1/2O2(g)
SO3(g);△H=-196.6 kJ/mol
难度: 中等查看答案及解析
-
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
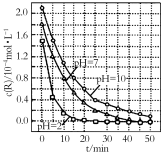
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越
强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
难度: 困难查看答案及解析
-
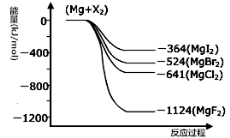
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
难度: 困难查看答案及解析
-
向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)
cC(g)。反应过程中,物质A的含量(A%)和C的含量(C%)随温度(T)的变化曲线如图所示,下列说法正确的是
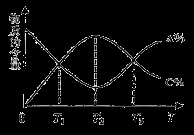
A.该反应在T1、T3温度时达到过化学平衡 B.该反应在T2温度时达到过化学平衡
C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应
方向移动
难度: 困难查看答案及解析
-
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3 H2 (g) = 2 NH3(g) ΔH = - 92.4 KJ/mol,则N≡ N键的 键 能 是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
难度: 中等查看答案及解析
-
反应CO(g)+2H2(g)
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
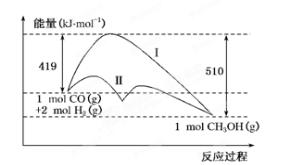
A.该反应的ΔH=+91 kJ/mol B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量 D.如果该反应生成液态CH3OH,则ΔH变大
难度: 中等查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·m
ol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
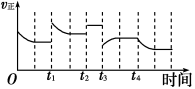
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
难度: 中等查看答案及解析
-
在温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:
CH4(g)+2NO2(g)
N2(
g)+CO2(g)+2H2O(g)△H=akJ/mol。测得有关数据如下表:
温度
时间/min
物质的量
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
x
0.15
下列说法正确的是
A.T1>T2,且a>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol
D.温度为T1时,达平衡时CH4 的转化率大于NO2的转化率
难度: 困难查看答案及解析
-
已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ·mol-1
CO(g)+
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
现有CO、H2和CO2组成的混合气体112.0 L(标准状况)完全燃烧后放出的总热量为851.4 kJ,并生成18 g液态水。则燃烧前混合气体中CO的体积分数为
A.80% B.40% C.60% D.20%
难度: 困难查看答案及解析
-
同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3
H2(g)
2NH3(g) △H= -92.6 kJ / mol。测得数据如下表:

下列叙述不正确的是
A.容器②中反应开始时v(正)> v(逆)
B.容器①、②中反应达平衡时压强相等
C.容器②中反应达平衡时,吸收的热量Q为9.26 kJ
D.若条件为“绝热恒容”,容器①中反应达平衡时n (NH3)< 0.6 mol
难度: 困难查看答案及解析