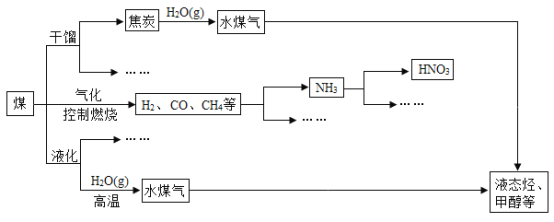
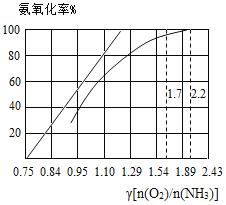
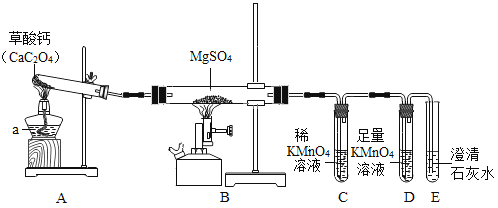
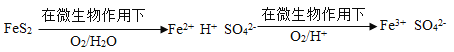-
化学与生产、生活密切相关。下列物质的用途与其化学性质无关的是( )
A.干冰用于舞台制作云海美景
B.小苏打用于做馒头时的发酵剂
C.还原铁粉用于月饼盒内的除氧剂
D.生石灰用于某些食品袋内的干燥剂
难度: 中等查看答案及解析
-
铜锈的主要成分是碱式碳酸铜。碱式碳酸铜受热分解的化学方程式为:Cu2(OH)2CO3
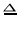 2CuO+X+CO2↑。下列说法正确的是( )
2CuO+X+CO2↑。下列说法正确的是( )A.反应前后固体物质中铜元素的质量分数不变
B.碱式碳酸铜中铜原子和氧原子的质量比为8:5
C.X是相对分子质量最小的氧化物
D.加热Cu2(OH)2CO3的实验装置和实验室用双氧水制取O2的发生装置相同
难度: 简单查看答案及解析
-
通过下列实验操作和现象能得出相应结论的是( )
实验操作
现象
结论
A
向收集满CO2的软塑料瓶中加入约1/3体积滴有石蕊试液的水,旋紧瓶盖,振荡
塑料瓶变瘪,溶液变红
CO2能与石蕊试液反应
B
往久置于空气中的氢氧化钠溶液滴加稀硫酸
有气泡
氢氧化钠溶液已变质
C
向某无色溶液中滴加氯化钡溶液
有白色沉淀
无色溶液中一定含有SO42-离子
D
把质量相同的镁条与锌粒同时放入相同浓度和等体积的盐酸中
镁条与盐酸产生气体的速率更快
镁的金属活动性比锌强
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混和溶液中,充分反应后过滤,得到滤液M和滤渣N,下列有关说法中,不合理的是
A.滤液M中一定存在Fe2+
B.滤渣N的质量一定小于加入铁粉的质量
C.滤渣N中一定没有单质镁
D.滤液M中至少含有两种金属阳离子
难度: 中等查看答案及解析
-
要除去下列物质中的少量杂质(括号内物质为杂质),下列实验方案设计中,不合理的是( )
A.CaCO3(CaCl2):加水溶解一过滤一 洗涤一干燥
B.N2(O2):将气体缓缓通过灼热的铜网
C.NaCl 溶液(Na2SO4):加入过量的BaCl2 溶液,过滤
D.KCl 溶液(K2CO3):加入适量的稀盐酸
难度: 中等查看答案及解析
-
下列各组物质能按照如图关系(“→”表示反应一步完成)相互转化的是( )
A
B
C
D
X
C
Fe2O3
Cu
CaCO3
Y
CO
Fe
CuO
Ca(OH)2
Z
CO2
FeCl3
Cu(OH)2
CaO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
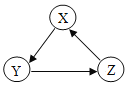
如图实验装置进行的相应实验,不能达到实验目的的是( )
A.用①所示装置除去CO2中含有的少量HCl气体
B.用②所示装置证明可燃物燃烧需要与氧气接触
C.用③所示装置制取少量CO2气体
D.在实验室中,用④所示装置除去少量“七中墨池”水中的泥沙
难度: 中等查看答案及解析
-
向一定量4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是
A.
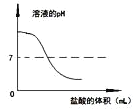 B.
B.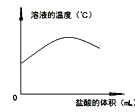
C.
 D.
D.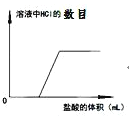
难度: 中等查看答案及解析
-
图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压).下列说法正确的是( )

A.燃烧匙内所装红磷或木炭的多少对实验结果无影响
B.反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的
C.p=0.79p0,p′=p0是因为红磷的着火点比木炭低
D.由图3可推出空气中氧气的含量
难度: 困难查看答案及解析
-
已知:在同温同压下,相同体积的任何气体所含的分子数目都相同:常温下二氧化硫气体和硫化氢气体混合,发生反应生成硫和水。现将常温常压下m个二氧化硫分子和n个硫化氢分子混合,若充分反应后气体的体积是反应前的一半,则m与n的比值是( )
A.1:5 B.1:3 C.1:2 D.1:1
难度: 困难查看答案及解析
-
某黑色固体粉末可能是Fe 、FeO、CuO、C中的一种或几种。为了探究其成分,小明同学按照下图所示流程进行了实验。
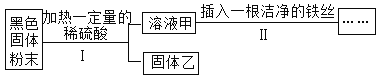
关于该实验有以下说法:
①若溶液甲呈浅绿色,则原黑色固体粉末中一定含有Fe;
②若步骤II中无明显现象,则固体乙中最多只能有四种物质;
③若步骤Ⅱ中有气泡产生,则原固体可能是纯净物也可能是混合物;
④若步骤Ⅱ中有红色固体析出,则固体乙中一定无CuO;
⑤若固体乙呈红色.则原固体中一定含有Fe和CuO。
以上说法中正确的个数是( )
A.1个 B.2个 C.3个 D.4个
难度: 困难查看答案及解析
-
往100gFeCl3和CuCl2的混合溶液中加入铁粉。已知FeCl3会先与铁粉发生反应:2FeCl3+Fe=3FeCl2。下图为加入铁粉的质量与反应后剩余固体的质量关系。下列说法不正确的是( )
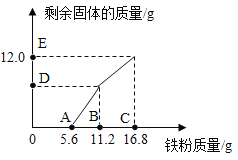
A.D点对应纵坐标为6.4
B.B点后溶液的颜色为蓝色
C.该100g溶液中的CuCl2的质量分数为13.5%
D.取DE两点间(不含D)的剩余固体加入盐酸,均有气泡产生
难度: 困难查看答案及解析