-
化学与生产、生活密切相关,下列有关说法中正确的是
A. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
B. 铝及其合金广泛应用,是因为铝的性质稳定,不易被腐蚀
C. 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应
D. 硅太阳能电池利用的是原电池原理
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA
B. 46g分子式为C2H6O的有机物中含有的C--H键的数目为6NA
C. 室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D. Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA
难度: 中等查看答案及解析
-
Y、Z、M为原子序数依次增大的短周期主族元素。已知,Z的原子最外层只有一个电子;Y与M同主族,且可形成MY2、MY3两种分子。下列叙述正确的是
A. 简单气态氢化物的稳定性:M>Y B. 铁与M的单质化合生成三价铁化合物
C. 电解Z的氯化物溶液制备Z的单质 D. Z、Y的化合物中阴阳离子数比为1:2
难度: 中等查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
探究化学反应的限度
取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究浓度对化学反应速率的影响
用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间
C
证明海带中含有碘元素
将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝
D
验证CH3COONa 溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法正确的是
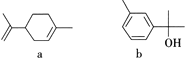
A. a中六元环上的一氯代物共有3种(不考虑立体异构)
B. b的分子式为C10H12O
C. a和b都能发生加成反应、氧化反应、取代反应
D. 只能用钠鉴别a和b
难度: 中等查看答案及解析
-
H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
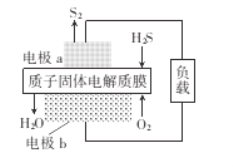
A. a是负极,电池工作时,电子的流动方向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+ = 2H2O
D. 当电路中通过4 mol电子时,有4 molH+经质子膜进入正极区
难度: 中等查看答案及解析
-
常温时,下列说法正确的是( )
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 0.1mol/L 的NaHA溶液,其pH=4,则:c(HA-)>c((H+)>c(H2A)>c(A2-)
C. 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7、Ka2=4.7×10-11,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
D. 将0.2mol/L的某一元酸HA溶液和0.1mol/LNaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液2c(OH-)+c(A-)=2c(H+)+c(HA)
难度: 中等查看答案及解析
 NaNO3(s)+ClNO(g) ∆H < 0 平衡常数K1
NaNO3(s)+ClNO(g) ∆H < 0 平衡常数K1  N2(g)+2CO2(g)。
N2(g)+2CO2(g)。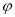 (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, 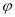 (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________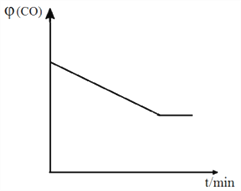
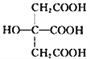 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题: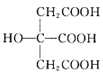 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____。 为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。
为Mn),该化合物的化学式为________,Se的配位数为______,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________nm(计算表达式)。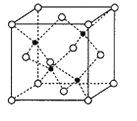
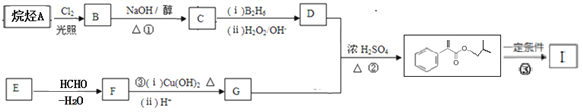
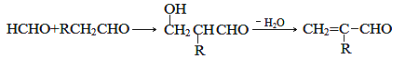
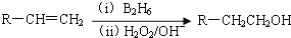
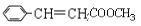 的合成路线______________。
的合成路线______________。