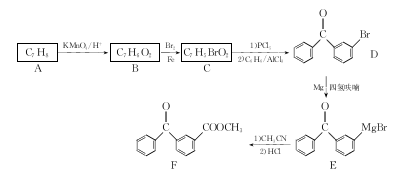
-
化学与日常生活、生产等密切相关。下列说法错误的是( )
A.使用LED照明灯属于“低碳生活”方式
B.研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
C.在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被腐蚀
D.施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列叙述正确的是( )
A.标准状况下,22.4 L乙烷中所含共价键数目为6NA
B.100 mL0.1 mol.L-1 FeCl3溶液中含有Fe3+的数目为0.01NA
C.0.2 mol Zn与一定量浓硫酸恰好完全反应,生成的气体分子数为0.2NA
D.1 L0.1 mol.L-l NaHCO3溶液中HC03-和CO32-离子数之和为0.1NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.钠跟乙醇反应比跟水反应剧烈
B.有机物ClCH2COOH中含有两种官能团
C.将苯与浓硝酸、浓硫酸共热以制取苯磺酸
D.将乙烷和氯气混合后光照制备纯净的氯乙烷
难度: 简单查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )

难度: 中等查看答案及解析
-
华盛顿大学的研究团队采用新型的太阳能热过程生产水泥,可实现C02零排放。当电解低于800℃ 时,碳酸钙先分解成为CaO和CO2,电解质为熔融的碳酸钠,基本原理如图所示,下列说法不正确的是( )
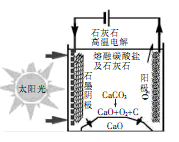
A.生产过程中能量转化方式是光能、电能转化为化学能
B.石墨电极的电极反应式为3CO2 +4e- =C+ 2CO32-
C.电解过程中熔融碳酸钠的物质的量不发生变化
D.电解过程中若产生11.2 LO2,则转移2 mol电子
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.常温下,pH=2的盐酸与硫酸的混合溶液中:

B.某0.1 mol.L-l的NaHA溶液的pH=4,该溶液中:
C.NaOH与CH3 COOH混合所得溶液中离子浓度不可能是:
D.等浓度的Na2 C03溶液与NaHC03溶液等体积混合,所得溶液中:
难度: 困难查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期元素。m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.0l mol.L-l s溶液的pH为12,q、s的焰色反应均呈黄色。上述物质的转化关系如图所示。下列说法正确的是( )
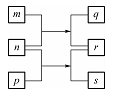
A.原子半径:W<X<Y<Z
B.通常状况下,X的氢化物可能呈气态、液态或固态
C.Y的氢化物的沸点比Z的氢化物的沸点高
D.由W、X、Y、Z四种元素只能组成一种化合物
难度: 困难查看答案及解析

 ,AgI呈黄色,且CN-优先与Ag+反应,
,AgI呈黄色,且CN-优先与Ag+反应,