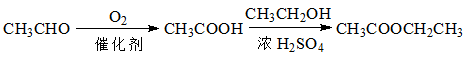-
化学与生产、生活、环境密切相关。下列说法错误的是( )
A.自行车钢架生锈主要是电化学腐蚀所致
B.硫酸钠溶液和氯化钡溶液均能使蛋白质变性
C.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-)
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HA酸性较强
D.对于反应2SO2(g)+O2(g)
2SO3(g),降温后(其他条件不变),若SO2的转化率增大,则SO2的体积分数增大,但△H和平衡常数值不变
难度: 中等查看答案及解析
-
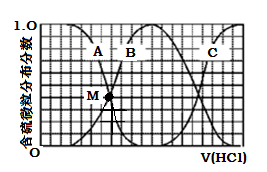
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是( )

A.曲线Ⅰ:滴加溶液到10 mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到20 mL时:
c(Cl-)=c(NH4+)>c(H+)=c(OH-)
C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:滴加溶液到10 mL时:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
难度: 困难查看答案及解析
-
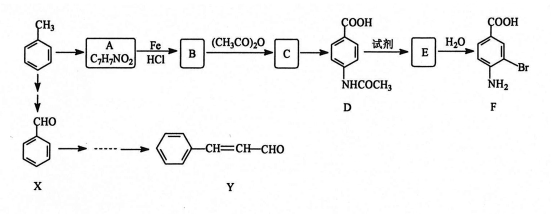
下列说法正确的是( )
A.C3H6O2的同分异构体中能在NaOH水溶液中发生水解反应的有3种
B.
可使Br2的CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
C.可以用高锰酸钾酸性溶液鉴别苯乙烯与甲苯
D.沸点:CH3CH2Br>CH3CH2OH
难度: 中等查看答案及解析
-
如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
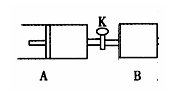
A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
难度: 困难查看答案及解析
-
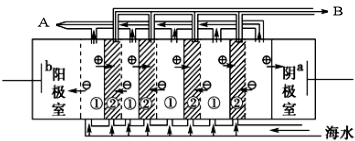
高铁酸盐在能源环保领域有广泛用途,用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列说法合理的是( )
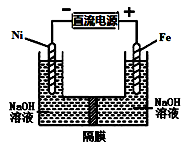
A.镍电极上的电极反应为2H2O+2e-
H2↑+2OH-
B.铁是阳极, 电极反应为Fe-2e-+OH-
Fe(OH)2
C.若隔膜为阴离子交换膜, 则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高, 最终溶液pH不变
难度: 困难查看答案及解析
-
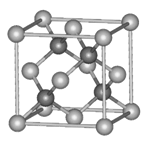
八硝基立方烷是一种新型高能炸药,该炸药的结构式如下图所示,由立方烷的氢全部被硝基取代制得,它与三硝基甲苯类似,对震动的敏感度比较低,据信是迄今最烈性的非核爆炸品。关于这种炸药,下列说法错误的是( )
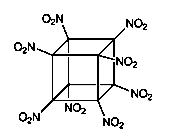
A.分子式为C8(NO2)8,同种元素的原子在分子中是毫无区别的
B.它爆炸时的反应方程式是:C8(NO2)8=8CO2+4N2,气体体积膨胀将引起激烈爆炸
C.八硝基立方烷是一种高能化合物, 分解时将吸收大量能量
D.八硝基立方烷爆炸后会产生大量烟雾
难度: 困难查看答案及解析