-
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
A.使用生物酶降解生活废水中的有机物,可防止水体的富营养化
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念
D.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染
难度: 中等查看答案及解析
-
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是
A.NaCl的电子式为
B.NaCl的水溶液是强电解质
C.23Na37Cl中质子数和中子数之比是8:7
D.电解熔融氯化钠可得到氯气和金属钠
难度: 中等查看答案及解析
-
下列现象或事实解释正确的是
A.铁制容器可盛装冷的浓硫酸,因为常温下铁和浓硫酸不反应
B.铝热反应需提供一定的能量引发,因为铝热反应为吸热反应
C.增加炼铁高炉的高度并不能提高CO的转化率,因为化学平衡没有移动
( )
D.鸡蛋清中加入2滴1%醋酸铅溶液后产生沉淀,因为蛋白质发生了盐析
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH—=AlO2—+2H2O
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl—
Mn2++Cl2↑+H2O
C.用惰性电极电解熔融氯化钠:2Cl—+2H2O
Cl2↑+H2↑+2OH—
D.用稀氢氧化钠吸收氯气:2OH—+Cl2=Cl—+ClO—+H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 1.7 g H2O2中含有的电子数为0.9 NA
B. 1 L 1 mol·L-1NH4Cl溶液含有NA个NH4+
C. 1 mol NaHSO4晶体中含有3NA个离子
D.含NA个Na+的Na2O溶解于1 L水中,Na+浓度为1 mol·L-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=7的溶液中:Fe3+、Na+、Cl-、NO3-
B.0.1mol·Lˉ1NaHC2O4溶液中:K+、Ba2+、OH-、Cl-
C.c(OH-)/c(H+)=1012的溶液中:K+、Ba2+、Cl-、Br-
D.含有大量ClO-的溶液中:K+、OH-、I-、SO32-
难度: 中等查看答案及解析
-
下列有关实验操作、原理或现象叙述正确的是

A.除去KCl溶液中混有的BaCl2,所加试剂的顺序: Na2CO3溶液、HCl溶液
B.图1烧杯中先出现白色沉淀后溶解
C.用如图2装置验证氧化性:ClO->Cl2>Fe3+
D.在NaHSO3溶液中滴入石蕊试液,验证溶液NaHSO3中存在水解平衡
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.在地壳中,C元素的含量位于第一位
B.C元素位于元素周期表中的第3周期第ⅠA族
C.A、B、D三种元素形成的化合物一定是强酸
D.B元素与氢元素形成化合物的化学式一定为H2B
难度: 中等查看答案及解析
-
以下实验方法能达到目的是
A.皮肤上沾有少量苯酚,立即用大量浓氢氧化钠溶液洗去
B.欲提纯鸡蛋白溶液中的蛋白质,用饱和的醋酸铅溶液进行盐析
C.金属钠非常活泼,应将其保存在汽油中,以隔绝空气和水
D.仅用溴水可鉴别苯、四氯化碳、2-戊烯、乙醇四种无色液体
难度: 中等查看答案及解析
-
25℃,a L 0.1000 mol/L CH3COOH溶液与b L 0.1000 mol/L NaOH溶液混合,下列说法正确的是
A. 若a>b,则pH一定小于7
B. 若a<b,则一定存在:n(OH-)-n(H+)>0.1(b-a)
C. c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则a≤b
D. 若pH =7,则a>b,且 c(Na+)=c(CH3COO-)+c(CH3COOH)
难度: 中等查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
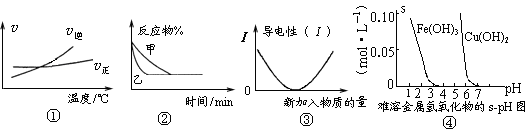
A.根据图①可判断可逆反应“A2(g)+3B2(g)
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
难度: 中等查看答案及解析
-
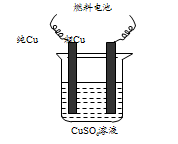
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,下图是该工艺图示(电极未标出)。
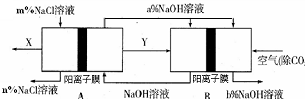
下列说法正确的是
A. X为H2,Y为Cl2
B. A池为电解池,且m<n
C. B池为燃料电池,且a<b
D. 该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 3B(g)
2C(g) ΔH=-192 kJ·mol-1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。
下列说法正确的是
A. 若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B. 若x:y=1:2,则平衡时,M中的转化率:A>B
C. 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90%
D. 若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,
v(正)<v(逆)
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:
c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
难度: 中等查看答案及解析