-
(1)①根据图1所示,写出反应的热化学方程式______________________________。

②根据图2所示情况,判断下列说法中正确的是( )
A.其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=+41kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.当H2O为液态时,其反应热值小于41
(2)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是___________________。
(3)图3是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:______________________________。a、b两条曲线分别代表由N2、H2合成氨的两个不同反应过程,其反应热△Ha ___△Hb(填“>”或“<”或“=”)。
难度: 中等查看答案及解析
-
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)
P4O10(s) ΔH1=−2 983.2 kJ·mol−1
P(s,红磷)+
O2(g)
P4O10(s) ΔH2=−738.5 kJ·mol−1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)
P4O6(s) ΔH= −1 638 kJ·mol−1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol−1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)
4PCl3(s)的反应热ΔH= 。
难度: 中等查看答案及解析
-
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5 kJ的热量,试写出甲醇燃烧的热化学方程式:__________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键
H—H
N—H
N≡N
键能/(kJ • mol−1)
436
391
945
已知反应N2+3H2
2NH3 ΔH=a kJ • mol−1。
试根据表中所列键能数据估算a的数值:______________________。
(3)盖斯定律告诉我们化学反应的能量变化和反应的过程无关,只与反应的终态和始态有关,依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)
CO2(g) ΔH1=−393.5 kJ • mol−1
2H2(g)+O2(g)
2H2O(l) ΔH2 =−571.6 kJ • mol−1
2C2H2(g)+5O2(g)
4CO2(g)+2H2O(l) ΔH3 =−2 599 kJ • mol−1
根据盖斯定律,计算298 K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的焓变_______________。
难度: 中等查看答案及解析
-
某氮肥厂氨氮废水中的氮元素多以
和NH3•H2O的形式存在,该废水的处理流程如图:

(1)过程Ⅰ:加入NaOH溶液,调节pH至9后,升温至30° C,通空气将氨赶出并回收。
用离子方程式表示加NaOH溶液的作用:__________________。
(2)过程Ⅱ:在微生物的作用下,
经过两步反应被氧化成
。两步反应的能量变化如图所示:
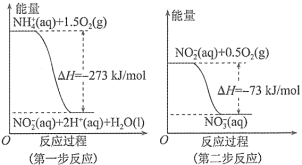
①第一步反应是________反应(填“放热”或“吸热”),判断依据______________________。
②1 mol NH4+(aq)全部被氧化成NO3−(aq)的热化学方程式是______________________________。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是__________。
难度: 中等查看答案及解析