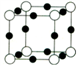
-
关于化学键的各种叙述中,下列说法中正确的是( )
A. 含有金属元素的化合物一定是离子化合物
B. 共价化合物里,一定不存在离子键
C. 由多种非金属元素组成的化合物一定是共价化合物
D. 由不同种元素组成的多原子分子里,一定只存在极性键
难度: 简单查看答案及解析
-
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和. 下列说法正确的是( )
A. 原子半径C>D>E,三者形成的简单离子中D离子的半径最小
B. 元素A所形成的氢化物常温下一定为气态
C. 元素C、D、E在自然界中均不能以游离态存在
D. 元素B的氧化物对应的水化物一定为强酸
难度: 困难查看答案及解析
-
下列有关卤族元素及其化合物的表示正确的是( )
A. 氟离子的结构示意图:
B. 次氯酸的结构式:H-Cl-O
C. 溴化铵的电子式:
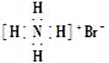 D. 质子数为53,中子数为78的碘原子:
D. 质子数为53,中子数为78的碘原子:难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 所有物质中都存在化学键
B. 由两种元素组成的分子中一定不存在非极性共价键
C. 含有离子键的化合物一定是离子化合物
D. 化学键断裂的过程必发生化学反应
难度: 简单查看答案及解析
-
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A. CO2和SiO2 B. C60和Ar C. NaCl和HCl D. CaO和CsCl
难度: 简单查看答案及解析
-
下列关于晶体的说法中,不正确的是( )
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
A. ①③④⑦ B. ②④⑥⑧ C. ③⑤⑦⑧ D. ③④⑥⑦
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 质子数c>d,离子的还原性Y2->Z-
B. 氢化物的稳定性H2Y>HZ
C. 原子半径X<W,第一电离能X<W
D. 电负性Z>Y>W>X
难度: 中等查看答案及解析
-
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
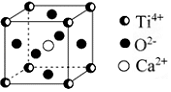
A. CaTiO3的摩尔质量为236
B. CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻
C. CaTiO3晶体中每个Ti4+与12个O2-紧相邻
D. CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻
难度: 简单查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
A. X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C. 元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液. 下列对此现象说法正确的是( )
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(H2O)4]2+
C. 该实验能证明[Cu(NH3)4]2+比氢氧化铜稳定
D. 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
下列描述中正确的是
A. ClO3-的空间构型为平面三角形
B. SiF4和 SO32-的中心原子均为 sp3杂化
C. 在所有的元素中,氟的第一电离能最大
D. C2H5OH 分子中共含有 8 个极性键,1 个 π 键
难度: 中等查看答案及解析
-
卤代烃C5H11Cl与C5H12O属于醇类的结构各有多少种( )
A. 5、3 B. 3、5 C. 10、8 D. 8、8
难度: 困难查看答案及解析
-
下列化学用语应用正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 乙醇的分子式:CH3CH2OH
C. 甲烷的结构式:CH4 D. 甲苯的键线式:
难度: 中等查看答案及解析
-
现有三组混合液:①乙酸乙酯和碳酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 中等查看答案及解析
-
下列有机物的命名中,正确的是( )
A.
 (2-乙基戊烷) B.
(2-乙基戊烷) B. 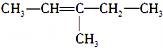 (3-甲基-2-戊烯)
(3-甲基-2-戊烯)C.
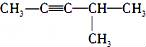 (2-甲基-戊炔) D.
(2-甲基-戊炔) D.  (1-甲基-5-乙基苯)
(1-甲基-5-乙基苯)难度: 简单查看答案及解析
-
在核磁共振氢谱中出现两组峰,其峰面积之比为3:2的化合物是( )
A.
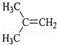 B.
B. 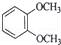 C.
C. 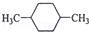 D.
D. 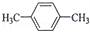
难度: 简单查看答案及解析
 的名称为________________________.
的名称为________________________. 的名称为______________________________.
的名称为______________________________.