-
下列各组分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4 C.Cl2、C2H2 D.NH3、HCl
难度: 中等查看答案及解析
-
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3分子比PH3分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
难度: 简单查看答案及解析
-
某元素基态原子4s轨道上有2个电子,则该基态原子价电子排布不可能是
A.3d84s2 B.3d94s2 C.4s24p1 D.4s24p2
难度: 简单查看答案及解析
-
已知:CH3C≡CH+CO+CH3OH
 M,N+CH3OH
M,N+CH3OH M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是
M+H2O。其中M的结构简式为CH2=C(CH3)COOCH3,下列说法错误的是A.N中所有碳原子可能共面 B.N转化为M的反应为取代反应
C.M可以使溴水褪色 D.N属于酯的同分异构体有3种
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.分子中键能越大,键长越长,则分子越稳定
B.失电子难的原子获得电子的能力一定强
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
难度: 中等查看答案及解析
-
燃料电池是一种连续地将燃料(如:氢气、甲烷、乙醇等物质)和氧化剂的化学能直接转换成电能的化学电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池工作时氢气、甲烷、乙醇等物质发生的反应均为氧化反应
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,则电池工作时的负极反应为C2H5OH-12e-=2CO2↑+3H2O
D.甲烷燃料电池的电解质若用H2SO4,则电池工作时H+向充入O2的一极移动
难度: 中等查看答案及解析
-
北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是
A.胆矾的化学式为CuSO4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
难度: 中等查看答案及解析
-
下列分子中不存在π键的是
A.CH4 B.C2H4 C.C2H2 D.C6H6
难度: 简单查看答案及解析
-
A、B、C、D、E为五种短周期元素。A、B、C是原子序数依次递增的同周期元素,且最外层电子数之和为15,A与C可形成AC2分子;B与D形成的气态化合物水溶液显碱性;E的质子数是A、B、C、D四种元素质子数之和的
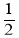 。下列说法正确的是
。下列说法正确的是A.原子半径:E>C>B>A>D
B.AC2、A2D2、E2C2均为直线型的共价化合物
C.由A元素形成的单质不一定是原子晶体
D.由A、B、C、D四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,6g乙酸中含有的C-H键数目为0.3NA
B.1.0molCH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
C.标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D.2.8g由N2和乙烯(C2H4)组成的混合气体中所含的原子数为0.2NA
难度: 中等查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
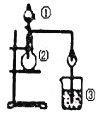
A
浓盐酸
MnO2
NaBr溶液
氧化性Cl2>Br2
B
浓氨水
碱石灰
Al2(SO4)3溶液
Al(OH)3具有两性
C
浓硫酸
Na2SO3
FeCl3溶液
SO2具有还原性
D
稀盐酸
Na2CO3
Na2SiO3
非金属性:C>Si
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都可得到Fe2O3
难度: 简单查看答案及解析
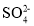 -
-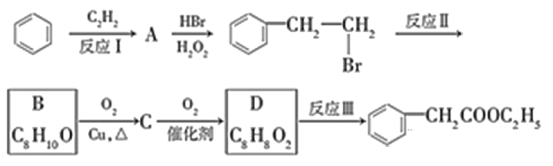
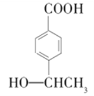 为起始原料(其他试剂任选),制备
为起始原料(其他试剂任选),制备 的合成路线流程图。合成路线常用的表示方式为X
的合成路线流程图。合成路线常用的表示方式为X B
B ……
……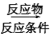 目标产物________
目标产物________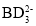 中心原子杂化轨道的类型为________杂化;
中心原子杂化轨道的类型为________杂化;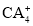 的空间构型为________。
的空间构型为________。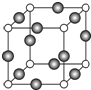
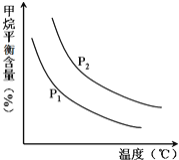
 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示: