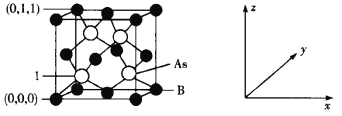
-
阿司匹林的有效成分是乙酰水杨酸(COOHOCOCH3),可以用水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为原料合成。下列说法正确的是
A. 可用酸性KMnO4溶液鉴别水杨酸和乙酰水杨酸
B. 已知HCHO为平面形分子,则乙酸酐中最多8个原子共平面
C. 1 mol乙酰水杨酸最多消耗2 mol NaOH
D. 服用阿司匹林时若出现水杨酸反应,应立即停药并静脉注射Na2CO3溶液
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.2.1g丙烯中所含的共用电子对总数为0.3NA
B.在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
C.过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D.5.6 g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
难度: 简单查看答案及解析
-
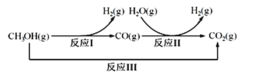
中国化学家研究出一种新型复合光催化剂(C3N4/CQDs),能利用太阳光高效分解水,原理如图所示。下列说法不正确的是
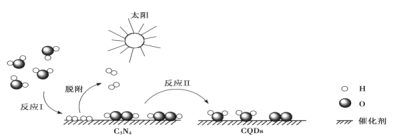
A.通过该催化反应,实现了太阳能向化学能的转化
B.反应I中涉及到非极性键的断裂和极性键的形成
C.反应II为:2H2O2
 2H2O+O2↑
2H2O+O2↑D.总反应为:2H2O
 2H2↑+O2↑
2H2↑+O2↑难度: 简单查看答案及解析
-
如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
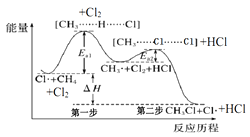
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.已知HI(g)
 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量B.已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
难度: 困难查看答案及解析
-
下列叙述中,正确的是( )
①分别电解NaCl、CuCl2两种溶液时,参加反应的物质是相同的 ②在海轮外壳上装若干铜块以减缓钢铁腐蚀③金属和石墨导电均为物理变化,电解质溶液导电是化学变化 ④不能自发进行的氧化还原反应,通过电解的原理有可能实现 ⑤Cu+2Ag+===Cu2++2Ag,反应既可以在原电池中实现,也可以在电解池中实现,其他条件相同时,二种装置中反应速率相同
A.③④ B.①②③④ C.③④⑤ D.①②
难度: 中等查看答案及解析
-
一种新型电池的工作原理如图所示。该电池工作时,下列说法错误的是
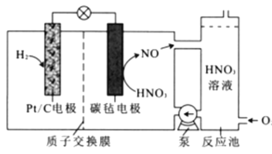
A.Pt/C电极为负极,质子通过交换膜从负极区移向正极区
B.理论上,当消耗22.4L(标准状况下)H2时,会消耗1molO2
C.反应池中发生总反应4NO+3O2+2H2O=4HNO3,实现HNO3再生
D.正极的电极反应为NO3-+4H++3e-=NO↑+2H2O
难度: 中等查看答案及解析
-
电解合成 1 , 2-二氯乙烷的实验装置如图所示。下列说法中正确的是
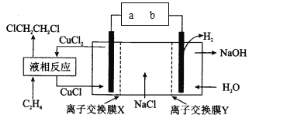
A.a为电源的负极
B.CuCl2能将C2H4还原为 l , 2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+ 2H2O + 2NaCl
 H2+ 2NaOH + ClCH2CH2Cl
H2+ 2NaOH + ClCH2CH2Cl难度: 简单查看答案及解析
-
下列图示与对应的叙述相符的是


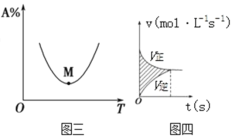
A.图一表示反应:mA(s)+nB(g)
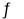 pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
pC(g)△H>0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.B.图二表示反应2CO(g)+2NO(g)
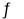 N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>a
N2(g)+2CO2(g),在其他条件不变时,改变起始CO的物质的量,平衡时N2的体积分数变化,由图可知NO的转化率b>c>aC.图三表示对于化学反应mA(g)+nB(g)
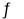 pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。D.图四所示图中的阴影部分面积的含义是(v正-v逆)
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.氯水中存在平衡:Cl2+H2O
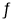 H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅
H++Clˉ+HClO,加入适量NaHCO3(s)后,溶液颜色变浅B.打开汽水瓶时有大量的气泡溢出
C.对于反应体系CO(g)+NO2(g)
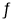 NO(g)+CO2(g),给平衡体系增大压强可使颜色变深
NO(g)+CO2(g),给平衡体系增大压强可使颜色变深D.对于反应2NO2(g)
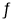 N2O4(g)△H<0,平衡体系升高温度颜色变深
N2O4(g)△H<0,平衡体系升高温度颜色变深难度: 简单查看答案及解析
-
下列实验方案能达到实验目的的是
A
B
C
D
实验方案

置于光亮处
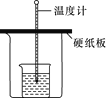

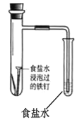
实验目的
验证甲烷与氯气发生化学反应
中和热的测定
验证乙炔的还原性
验证铁钉发生析氢腐蚀
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g) ⇌nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
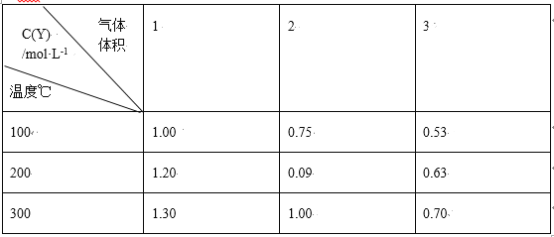
下列说法正确的是
A.m>n B.Q<0
C.温度不变,压强增大,Y的质量分数减少 D.体积不变,温度升高,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)
 COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
Cl2
COCl2
COCl2
Ⅰ
500
1.0
1.0
0
0.8
Ⅱ
500
1.0
a
0
0.5
Ⅲ
600
0.5
0.5
0.5
0.7
下列说法中正确的是
A.容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B.该反应正反应为吸热反应
C.容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D.若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
难度: 困难查看答案及解析
-
下列说法正确的有( )个
①可以用Cu(OH)2悬浊液用一种试剂鉴别甲酸、乙酸、乙醛、乙醇。
②可用酸性K2Cr2O7溶液检验是否酒后驾车,该应用利用了乙醇的还原性和低沸点的性质。
③向银氨溶液中加入几滴乙醛后用酒精灯加热至沸腾制可得银镜。
④向足量的浓苯酚溶液中滴入少量溴水,可观察到有白色沉淀生成,该沉淀为2,4,6-三溴苯酚。
⑤该分子
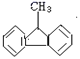 中的碳原子可能都在同一平面。
中的碳原子可能都在同一平面。⑥做过银镜反应实验后的试管,用氨水洗涤。
A.5 B.4 C.3 D.2
难度: 简单查看答案及解析
 2NH3(g),达到平衡的标志有_______________。
2NH3(g),达到平衡的标志有_______________。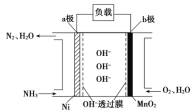
 2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH=-681.8kJ·mol-1,对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
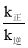 =________(计算结果用分数表示)
=________(计算结果用分数表示) Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
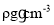 ,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。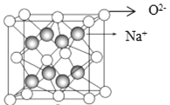
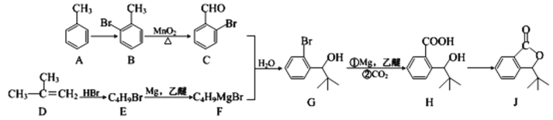
 的合成路线图________________(无机试剂和乙醚任用,合成路线图示例见本题题干)。
的合成路线图________________(无机试剂和乙醚任用,合成路线图示例见本题题干)。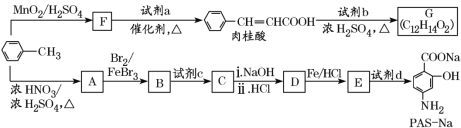
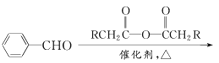
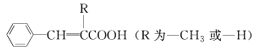
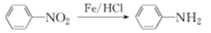
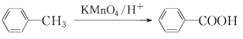
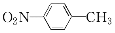 为起始原料制备
为起始原料制备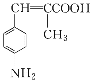 的合成路线。
的合成路线。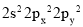 ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键