-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
难度: 简单查看答案及解析
-
有共价键的离子化合物是
A.NaOH B.H2SO4 C.CH2Cl2 D.AlCl3
难度: 简单查看答案及解析
-
蒸馏实验中需要用到的仪器是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列属于强电解质的是
A.Al B.CH3OH C.CH3COOH D.BaSO4
难度: 简单查看答案及解析
-
反应3Br2+6NaOH
 5NaBr+NaBrO3+3H2O中,氧化产物是
5NaBr+NaBrO3+3H2O中,氧化产物是A.Br2 B.NaBr C.NaBrO3 D.H2O
难度: 简单查看答案及解析
-
下列物质的名称不正确的是
A.(NH4)2SO4·FeSO4 ·6H2O:摩尔盐 B.CH3CH(CH2CH3)CH2CH2CH3:2-乙基戊烷
C.CO(NH2)2:尿素 D.CaSO4·2H2O:生石膏
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.硝基苯:
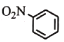 B.镁离子的结构示意图:
B.镁离子的结构示意图: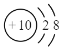
C.NH3分子的比例模型:
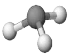 D.原子核内有8个中子的碳原子:
D.原子核内有8个中子的碳原子: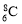
难度: 简单查看答案及解析
-
下列说法不正确的是
A.金刚石和石墨互为同素异形体 B.
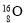 和
和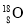 互为同位素
互为同位素C.乙醇和二甲醚互为同分异构体 D.
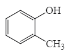 和
和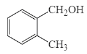 互为同系物
互为同系物难度: 简单查看答案及解析
-
下列说法不正确的是
A.钠和钾的合金用于快中子反应堆作热交换剂
B.35%甲醛溶液有防腐杀菌效果,可用于食品防腐
C.可利用二氧化碳制造全降解塑料
D.可用超纯硅制造的单晶硅来制芯片
难度: 简单查看答案及解析
-
下列说法不正确的是
A.蓝色的CoCl2溶液加浓盐酸可以变为红色
B.含苯环的蛋白质与浓硝酸作用会产生黄色固体
C.加热MgCl2·6H2O可以制得Mg(OH)Cl
D.纤维素溶解在铜氨溶液中,然后压入稀酸可得铜氨纤维
难度: 简单查看答案及解析
-
下列说法不正确的是
A.某些生活垃圾可用于焚烧发电
B.地沟油禁止食用,但可以用来制肥皂或生物柴油
C.石油裂解主要是为了获得气态不饱和短链烃
D.煤是由有机物和无机物组成的复杂的混合物,其中含有焦炭、苯、甲苯等
难度: 中等查看答案及解析
-
下列说法正确的是
A.火柴头的浸泡液中滴加AgNO3溶液稀HNO3溶液,可检验火柴头是否含有氯元素
B.测定新制氯水的pH时,先用玻璃棒蘸取液体滴在pH试纸上,再与标准比色卡对照
C.检验牙膏中是否含有甘油,可选用新制的氢氧化铜悬浊液,若含有甘油,则产生绛蓝色沉淀
D.将阿司匹林粗产品置于烧杯中,搅拌并缓慢加入饱和NaHCO3溶液,目的是除去粗产品中的水杨酸聚合物
难度: 中等查看答案及解析
-
下列事实不能说明有机物分子中原子或原子团直接相连时而产生相互影响的是
A.苯酚能与NaOH溶液反应而乙醇不能
B.等物质的量的乙醇和甘油与足量的金属钠反应,后者产生的氢气比前者多
C.苯与液溴在铁作催化剂下发生反应,而苯酚与浓溴水混合就能发生反应
D.甲苯能使酸性高锰酸钾溶液褪色而甲烷不能
难度: 中等查看答案及解析
-
探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L−1 H2C2O4的pH=1.3)
实验
装置
试剂a
现象
①
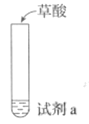
Ca(OH)2溶液(含酚酞)
溶液褪色,产生白色沉淀
②
少量NaHCO3溶液
产生气泡
③
酸性KMnO4溶液
紫色溶液褪色
④
C2H5OH和浓硫酸
加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式不正确的是
A.H2C2O4有酸性,Ca(OH)2+ H2C2O4
 CaC2O4↓+2H2O
CaC2O4↓+2H2OB.酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4
 NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2OC.H2C2O4具有还原性,2
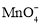 +5
+5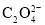 +16H+
+16H+ 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2OD.H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH
 C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O难度: 中等查看答案及解析
-
下列说法正确的是
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.仅用新制氢氧化铜悬浊液(必要时可加热)无法鉴别甲酸、乙醇、乙醛
难度: 中等查看答案及解析
-
泛酸又称为维生素B5,在人体内参与糖、油脂、蛋白质的代谢过程,具有抗脂质过氧化作用,其结构为
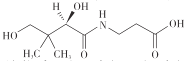 ,下列有关该化合物的说法不正确的是
,下列有关该化合物的说法不正确的是A.该物质可发生水解反应,水解产物均能发生缩聚反应
B.1mol该物质与足量 NaOH 溶液反应,最多可消耗 2molNaOH
C.该物质在铜、银等催化剂存在下可以被氧气氧化生成醛基和酮羰基
D.该物质在浓硫酸、Al2O3或 P2O5等催化剂作用下可发生脱水反应,生成碳碳双键
难度: 中等查看答案及解析
-
下列说法正确的是
A.中和pH和体积均相等的氨水、NaOH溶液,所需HCl的物质的量相同
B.在醋酸钠溶液中再加入少量水,水解平衡正向移动
C.用冰醋酸、蒸馏水和容量瓶可以配制pH=1的醋酸溶液
D.室温下pH=12的Ba(OH)2溶液与pH=2的盐酸恰好中和,消耗二者体积比为1:2
难度: 中等查看答案及解析
-
某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
离子
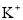
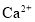
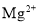
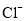
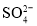
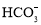
含量
9360
83
200
1100
16000
1200
118
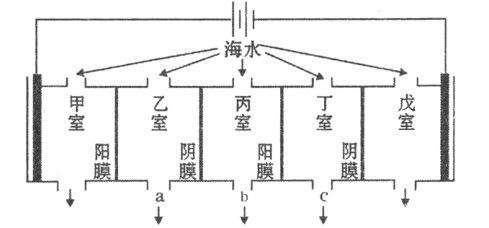
A.甲室的电极反应式为:
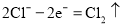
B.乙室和丁室中部分离子的浓度增大,淡水的出口为b
C.当戊室收集到
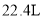 (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为
(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为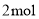
D.淡化过程中易在戊室形成水垢
难度: 困难查看答案及解析
-
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)
 HCOOH(g) 测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )
HCOOH(g) 测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )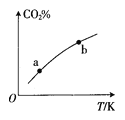
A.①② B.①③
C.②④ D.③④
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 标准状况下22.4 L异丁烷的分子数为NA
B. 78 g苯(C6H6)和苯乙烯(C8H8)的混合物中含有的碳氢键数一定为6NA
C. 某温度下,1L pH=3的醋酸溶液稀释到10L时,溶液中H+的数目大于0.01NA
D. 向仅含0.2 mol FeI2的溶液中持续通入Cl2,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA 。(不考虑Cl2与H2O的反应)
难度: 中等查看答案及解析
-
采用阴离子交换法合成了一系列不同 Zn 和 Pt 含量的PtSn-Mg(Zn)AlO催化剂用于乙烷脱氢反应[CH3CH3(g)⇌CH2 = CH2 (g)+H2(g) △H>0],实验结果表明,在水滑石载体中掺杂少量的 Zn 对乙烷脱氢反应有明显影响,如图所示为不同Zn含量PtSn催化剂的乙烷催化脱氢反应中,乙烷的转化率随时间的变化。下列说法不正确的是( )
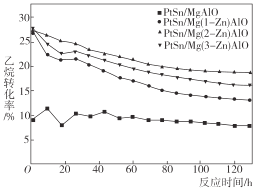
A.由图可知,PtSn/Mg(2-Zn)AlO催化剂的催化反应活性最优
B.一定温度下,将nmol乙烷放入VL密闭容器中进行催化脱氢,维持容器体积不变,测得乙烷平衡转化率为a,则该温度下反应的平衡常数K=
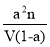
C.升高温度,平衡逆向移动
D.随着反应时间的延长,乙烷转化率逐渐稳定,催化活性保持在相对稳定的阶段
难度: 困难查看答案及解析
-
如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
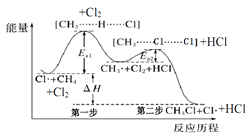
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
难度: 困难查看答案及解析
-
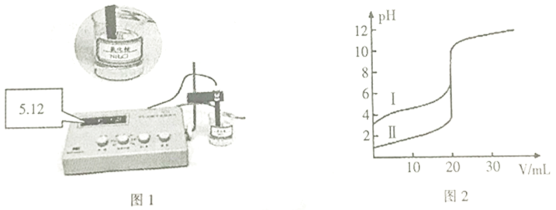
常温下,用0.1 mol·L1 KOH溶液滴定10 mL 0.1 mol·L1 HA(Ka=1.0×105)溶液的滴定曲线如图所示。下列说法错误的是

A.a点溶液的pH约为3
B.水的电离程度:d点>c点
C.b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e点溶液中:c(K+)=2c(A-)+2c(HA)
难度: 中等查看答案及解析
-
家用消毒剂种类繁多,医用酒精(75%的乙醇水溶液)、84消毒液(次氯酸钠溶液)、高锰酸钾消毒片、滴露消毒液(氯间二甲苯酚)等,消毒剂之间切不可随意相互混用。下列说法不正确的是
A.高锰酸钾消毒片投入到84消毒液中,高锰酸钾可能将次氯酸钠氧化产生氯气
B.高锰酸钾消毒片放入滴露消毒液中,高锰酸钾可能将氯间二甲苯酚氧化从而降低消毒效果
C.84消毒液和滴露消毒液混用时,消毒效果会降低很多,也有可能产生氯气
D.医用酒精和84消毒液混合,乙醇可能将次氯酸钠还原,降低消毒效果
难度: 简单查看答案及解析
-
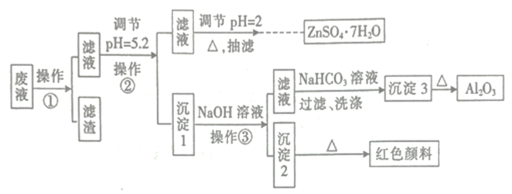
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:
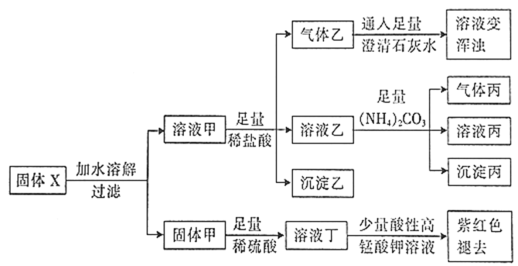
下列说法正确的是
A.气体乙和气体丙都为纯净物
B.溶液甲中一定含有AlO
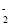 ,可能含有
,可能含有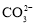
C.溶液丁中的阳离子一定只含H+、Fe2+
D.固体粉末X中一定含有FeO、Na2S2O3、NaAlO2,可能含有NaHCO3、Na2CO3
难度: 困难查看答案及解析
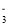 ______C6H5OH(填“>” 、“<”或“=”);用一个化学方程式说明上述强弱关系______________。
______C6H5OH(填“>” 、“<”或“=”);用一个化学方程式说明上述强弱关系______________。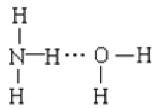 B.
B.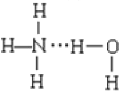
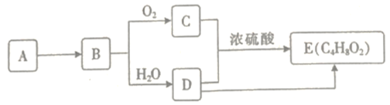
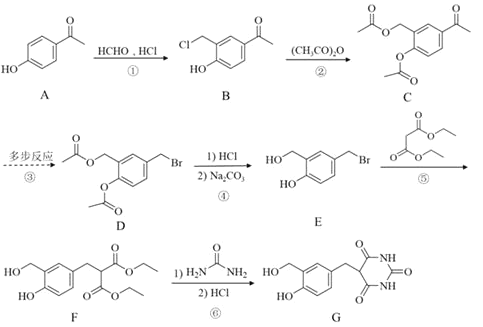
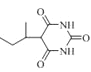 的合成线路(其它试剂任选)_________。
的合成线路(其它试剂任选)_________。