-
下列说法正确的是( )。
A.自然界中的所有原子都处于基态
B.同一原子处于激发态时的能量一定高于基态时的能量
C.无论原子种类是否相同,基态原子的能量总是低于激发态原子的能量
D.激发态原子的能量较高,极易失去电子,表现出较强的还原性
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法正确的是( )
A.医用酒精和84消毒液(NaClO溶液)混合使用能增强它们的消毒效果
B.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
C.疫情期间可以多吃富含纤维素的食物,它们在人体内都可以通过水解反应提供能量
D.混凝法、中和法和沉淀法是常用的工业污水处理方法
难度: 简单查看答案及解析
-
以富含纤维素的农作物为原料,合成 PEF 树脂的路线如下:

下列说法不正确的是
A.葡萄糖、果糖均属于多羟基化合物
B.5-HMF→FDCA 发生氧化反应
C.单体 a 为乙醇
D.PEF 树脂可降解以减少对环境的危害
难度: 困难查看答案及解析
-
下列数据是对应物质的熔点,有关的判断正确的是( )
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920℃
97.8℃
1291℃
190℃
2073℃
-107℃
-57℃
1723℃
A.只要含有阴离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子结构
C.同族元素的氧化物不可能形成不同类型的晶体
D.金属晶体的熔点一定比分子晶体的高
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述不正确的是( )
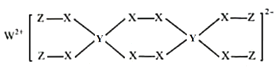
A.简单氢化物的稳定性:X>Y B.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为弱酸 D.该化合物中各元素均满足8电子稳定结构
难度: 中等查看答案及解析
-
报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如图。则这种合金的化学式为
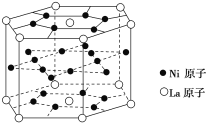
A.LaNi3 B.LaNi4
C.LaNi5 D.LaNi6
难度: 简单查看答案及解析
-
在2.0 L的容器中,加入2.0 mol PCl5,[ PCl5(g)⇌PCl3(g) + Cl2(g) ]在一定条件下达到平衡后,Cl2为0.3 mol,在恒温恒容,若此时移走1.0 mol PCl5,再次达到平衡时PCl3的物质的量浓度是( )
A.0.075 mol/L B.0.15 mol/L
C.小于0.5 mol/L D.大于0.075 mol/L ,小于0.5 mol/L
难度: 中等查看答案及解析
-
向10 mL 0.2 mol/L的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )
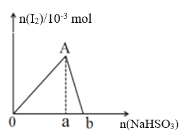
A.A点对应的I2的物质的量为1.0×10-3 mol
B.oa : ab = 4 : 1
C.当溶液中的n(I2) = 5×10-4 mol时,加入NaHSO3的物质的量可能为2.5×10-3 mol或5.5×10-3 mol
D.由ab段反应可知,氧化性I2 >
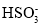
难度: 中等查看答案及解析
-
下列有关实验操作、现象及结论都正确的是
选项
实验操作
现象
结论
A
在某溶液中加入少量新制氯水,再滴几滴KSCN溶液
溶液变红
溶液中一定含有Fe2+
B
在酒精灯上加热铝箔
铝箔熔化但不滴落
熔点:氧化铝>铝
C
取1mL蔗糖溶液,加入5滴稀硫酸,水浴加热一段时间后,再加入少量新制Cu(OH)2悬浊液,加热至沸腾
无砖红色沉淀产生
蔗糖未水解
D
向1mL 0.1mol/L AgNO3溶液中加入几滴0.1mol/L NaCl溶液后,再向其中滴加几滴0.1mol/L KI溶液
先产生白色沉淀,后产生黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列粒子中与
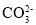 构型相同且中心原子的杂化方式也相同的是( )
构型相同且中心原子的杂化方式也相同的是( )A.HCHO B.SO2 C.H2O D.NH3
难度: 中等查看答案及解析
-
25℃时,向0.1L0.1mol·L-1CH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中离子浓度关系如下图所示(忽略溶液体积变化)。下列有关叙述正确的是
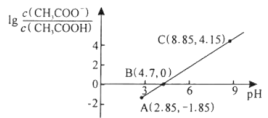
A.25℃,CH3COOH的Ka数量级为10-4
B.B点:加入的NaOH的物质的量为0.005mol
C.A点:c(CH3COO-)+c(OH-)+c(CH3COOH)-c(H+)>0.1mol·L-1
D.A到C的过程中不考虑温度变化:
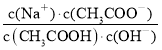 增大
增大难度: 困难查看答案及解析
-
2019年诺贝尔化学奖授予对锂离子电池研究有突出贡献的科学家。一种“大气固碳”的锂离子电池工作原理如图所示,该电池在充电时,通过催化剂的选择性控制,只有Li2CO3被氧化,释放出CO2和O2。下列说法不正确的是
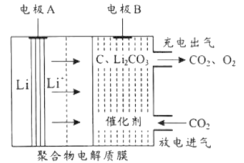
A.该电池应选用无水电解质
B.该电池放电时的正极反应为4Li++3CO2+4e-=C+2Li2CO3
C.充电时若电极A质量增加14g,则聚合物电解质膜上通过电子2mol
D.该电池放电、充电各一次且都转移4mole−时,理论上能固定1molCO2
难度: 中等查看答案及解析
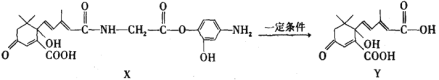
 )上的一个H 原子被—C4H9 取代后的产物共有32种
)上的一个H 原子被—C4H9 取代后的产物共有32种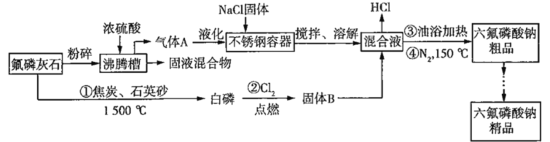
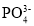 )=___________mol/L。
)=___________mol/L。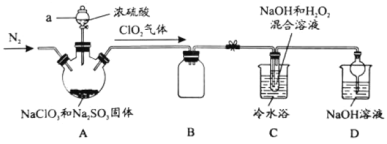
 =
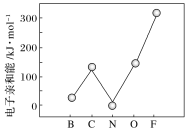
= 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________(填字母序号)。
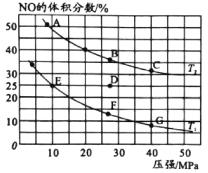
 N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表: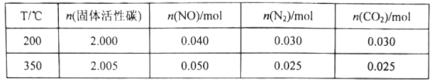
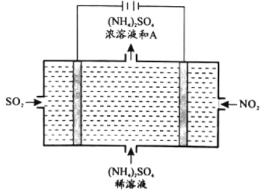
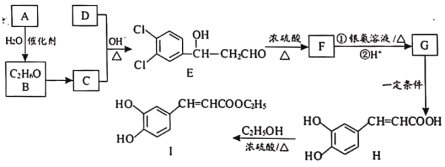

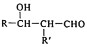
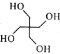 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A B……
B……