-
下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
X、Y、Z、W是原子序数依次增大的前20号元素,最外层电子数之和为15,X-具有很强的还原性,Y和Z原子的L层均达到8电子结构,Z-和W+具有相同的电子层结构。下列叙述正确的是
A. 离子半径大小:W+>Y2->Z-
B. 单质的沸点:Y>Z>X
C. 氧化物的水化物的酸性:Y<Z
D. 元素X和Y、Z、W都能形成共价化合物
难度: 中等查看答案及解析
-
化学与社会、生活密切相关,下列叙述错误的是
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 福尔马林严禁作食品的保鲜剂
C. 豆浆属于胶体,煮沸后蛋白质变成了氨基酸
D. 含重金属离子的工业废水,可通过电解等方式进行处理
难度: 简单查看答案及解析
-
战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A. CaO B. SiO2 C. NaHCO3 D. CaCO3
难度: 简单查看答案及解析
-
下列说法错误的是
A. 在海轮的外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极保护法
B. 原电池的负极和电解池的阳极均发生失电子的氧化反应
C. 催化剂不能降低反应活化能,但能增大活化分子的百分数,从而增大反应速率
D. 铜锌原电池连接电流计,根据电流计中指针偏转方向比较铜锌金属活动性
难度: 中等查看答案及解析
-
下列叙述错误的是
A. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
B. FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成
C. 从分类的角度看,混合物、分散系、胶体的从属关系如图所示:

D. 硫酸厂附近的雨水样品在空气中放置2小时后,测得pH变小,因为样品吸收了空气中的CO2
难度: 简单查看答案及解析
-
下列关于有机化合物的说法错误的是
A. 棉、麻、羊毛完全燃烧都只生成CO2和H2O
B. 室温下,在水中的溶解度乙醇大于溴乙烷
C. 乙烯和苯乙烯分子中所有原子均能在同一平面上,都能使溴水褪色
D. 乙烯与分子式为C3H6 的有机物不一定互为同系物
难度: 简单查看答案及解析
-
下列关于C60、H3、O2-、N5+等微粒的叙述错误的是
A. 碳、氢、氧、氮元素各含有不同核素
B. H3与H2化学性质相同,互为同位素
C. C60与N5+中都含有共价键
D. KO2属于含有共价键的离子化合物
难度: 简单查看答案及解析
-
高氯酸铵(NH4ClO4)常作火箭发射的推进剂,在400℃时开始分解,产物为N2、Cl2、O2、H2O,用以下装置进行NH4ClO4分解实验。下列有关叙述正确的是
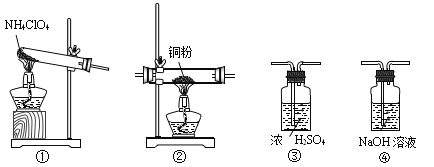
A. 高氯酸铵分解产生的Cl2、N2、O2都可用排空气法收集
B. 可按①③②④的连接顺序制得干燥纯净的N2
C. 1mol NH4ClO4分解,标准状况下收集到气体体积为44.8L
D. 装置①也可用于实验室加热NH4Cl或NH4NO3制备NH3
难度: 中等查看答案及解析
-
下列实验操作所对应的现象、结论均正确的是
选项
操作
现象
结论
A
SO2通入BaCl2溶液,然后滴入稀硝酸
产生白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化为BaSO4
B
向含有酚酞的Na2CO3溶液中加入BaCl2溶液
溶液颜色变浅
Na2CO3溶液中水解平衡向右移动
C
用pH试纸测定NaC1和NaF溶液的pH
pH(NaC1)<pH(NaF)
F元素非金属性强于C1
D
向足量FeI2溶液中滴加2滴氯水,再分别滴加①淀粉溶液②KSCN溶液
①溶液变蓝
②无明显现象
还原性:I->Fe2+
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 2L0.5 mol•L-1NaHSO4溶液中含有的H+个数为NA
B. 1mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
C. 常温下,将56gFe加入到足量的浓硝酸中,转移电子数为3 NA
D. 标准状况下,11.2 L乙烯和丙烯的混合气体中含C-H键的数目为2.5NA
难度: 中等查看答案及解析
-
已知:2CrO42-+2H+
 Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是
Cr2O72-+H2O。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法正确的是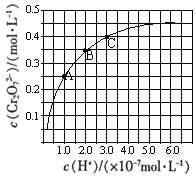
A. 平衡时,pH越小,c(Cr2O72-)越小
B. A点CrO42-转化为Cr2O72-反应的平衡常数的数量级为1014
C. C点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7 mol•L-1
难度: 困难查看答案及解析
-
如图所示,b、d是运用有机合成制备的具有立体结构的有机物,p、m是广泛存在于动植物体内萜类化合物,下列说法正确的是
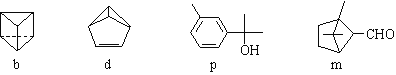
A. b与d互为同分异构体,p与m互为同分异构体
B. b、d、p中,只有p的所有碳原子在同一个平面上
C. d、p、m均可与酸性高锰酸钾溶液反应
D. b的二氯代物有三种,d与H2加成后的产物的一氯代物有四种
难度: 中等查看答案及解析
-
奥克托今是一种猛(性)炸药,学名环四亚甲基四硝胺,简称HMX,其结构简式如图所示。密闭容器中HMX发生自爆时产生的氮气和一氧化碳的分子数之比为
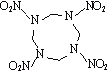
A. 1 : 1 B. 2 : 1 C. 1 : 2 D. 3 : 2
难度: 简单查看答案及解析
-
某种光电池的工作原理为:AgCl(s)+Cu+(aq)
 Ag(s)+Cu2+(aq)+Cl-(aq)。图为该光电池发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是
Ag(s)+Cu2+(aq)+Cl-(aq)。图为该光电池发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是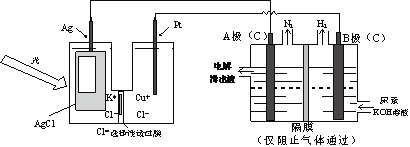
A. 光电池工作时,Ag极为电流流出极,发生氧化反应
B. 制氢装置溶液中K+移向A极
C. 光电池中工作时,Pt电极发生的反应为:2Cl--2e-=Cl2↑
D. 制氢装置工作时,A极的电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
难度: 中等查看答案及解析
-
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。已知盐酸浓度大于1mol•L-1时,发生反应:PbCl2(s)+2Cl-(aq)═PbCl42-(aq)。下列叙述正确的是
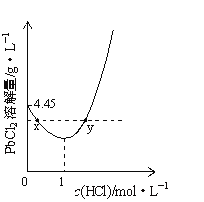
A. 盐酸浓度越小,Ksp(PbCl2)越小
B. x、y两点对应的溶液中c(Pb2+)相等
C. 当盐酸浓度为1mol•L-1时,溶液中c(Pb2+)一定最小
D. 当盐酸浓度小于1mol•L-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
难度: 困难查看答案及解析
 [Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl‾+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液 B.
B.  C.
C. D.
D. E.
E. F.
F.
 CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。
CO(NH2)2(l)+H2O(g)。温度为TK时,将68gNH3和88gCO2充入容积为100L的恒容密闭容器中,发生上述反应。测得平衡时CO2和H2O(g)物质的量相等。下列叙述正确的是____________。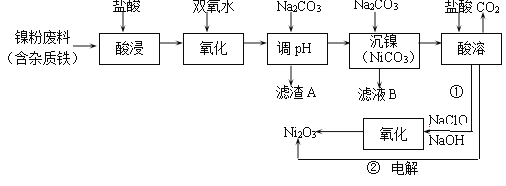
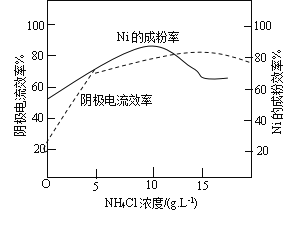
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示: N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示: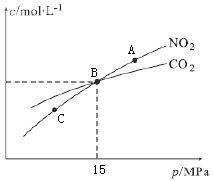
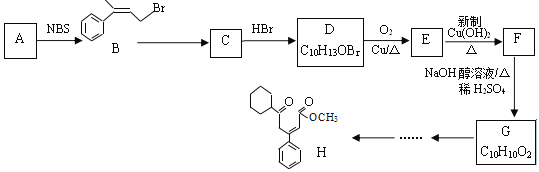
 R-CH=CH-CH2-Br
R-CH=CH-CH2-Br RCH2CH2Br
RCH2CH2Br 的合成路线____________________。
的合成路线____________________。