-
古诗词中包含了丰富的化学知识,下列说法错误的是
A.梨花淡白柳深青,柳絮飞时花满城:柳絮的主要成分属于糖类
B.高堂明镜悲白发,朝如青丝暮成雪:白发的主要成分为蛋白质
C.墨滴无声入水惊,如烟袅袅幻形生:墨滴能产生丁达尔效应
D.煮豆燃豆萁,豆在釜中泣:豆科植物可自然固氮,该过程属于物理变化
难度: 简单查看答案及解析
-
实验室利用苯与浓硝酸、浓硫酸制取并提纯硝基苯的实验过程中,下列装置未涉及的是
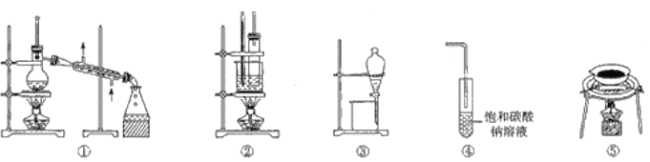
A.①② B.①③ C.③④ D.④⑤
难度: 中等查看答案及解析
-
SF6可用作高压电力设备中的“气体绝缘开关”,由S(g)与F2(g)制备SF6(g)的能量变化如图所示,下列说法正确的是
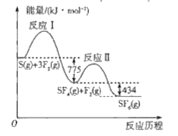
A.若已知S-F键的键能则可确定F-F键的键能
B.S(g)+3F2(g)=SF6(g)△H=+1209kJ·mol-1
C.与S(g)+3F2(g)=SF6(g)相比,S(s)+3F2(g)=SF6(g)放出的热量较多
D.由于反应Ⅰ放出的热量大于反应Ⅱ,所以反应速率:Ⅰ>Ⅱ
难度: 中等查看答案及解析
-
100℃时,在不同金属离子存在下,过氧化氢经过24h的分解率如下表所示:
离子
加入量(mg·L-1)
分解率/%
离子
加入量(mg·L-1)
分解率/%
无

2
Fe2+
1.0
15
Al3+
10
2
Cu2+
0.1
86
Zn2+
10
10
Cr3+
0.1
96
下列有关说法正确的是
A.能使过氧化氢分解反应活化能降低最多的离子是Al3+
B.催化剂可以使平衡移动,提高过氧化氢的分解率
C.若向过氧化氢中加入水,过氧化氢的分解速率加快
D.用等量H2O2制O2时,与自身分解相比,加入足量酸性KMnO4溶液可得到更多O2
难度: 简单查看答案及解析
-
过氧化钠是常见的消毒剂与供氧剂,在呼吸面具中使用时发生反应:2Na2O2+2CO2=2Na2CO3+O2.已知NA为阿伏加德罗常数的值,下列有关说法中正确的是
A.物质的量均为1mol的Na2O2和Na2CO3所含离子数目均为3NA
B.反应过程中,固体每增重28g转移的电子数目为2NA
C.室温下,4.4gCO2中共用电子对数目为0.2NA
D.44.8LCO2与O2的混合气体中所含氧原子数目为4NA
难度: 中等查看答案及解析
-
过二硫酸(
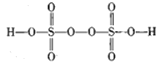 )极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是
)极易溶于水,且在水中会逐渐水解得到硫酸和过氧化氢:H2S2O8+H2O=H2SO4+H2SO5、H2SO5+H2O=H2SO4+H2O2,下列说法中错误的是A.过二硫酸与高锰酸钾溶液反应可产生氧气
B.过二硫酸铵溶于水所得溶液显酸性
C.将过二硫酸加入滴有紫色石蕊试液的水中,溶液显红色
D.过二硫酸可用来除去稀硫酸中的亚硫酸杂质
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加NaOH溶液至水的电离程度最大:2OH-+NH4++H+=NH3·H2O+H2O
B.硫酸型酸雨久置,pH减小:
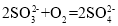
C.将Cl2通入少量FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合:
 +7H++H2O=3Al(OH)3↓+Al3+
+7H++H2O=3Al(OH)3↓+Al3+难度: 中等查看答案及解析
-
PMMA骨水泥的成分为聚甲基丙烯酸甲酯,结构简式为
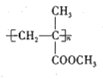 ,其单体丙的制备原理如图所示,下列说法中错误的是
,其单体丙的制备原理如图所示,下列说法中错误的是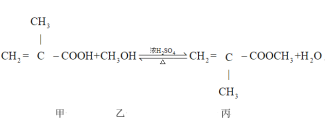
A.丙所含的官能团有碳碳双键、酯基
B.可以用饱和碳酸氢钠溶液鉴别甲、乙、丙
C.丙与聚甲基丙烯酸甲酯互为同系物
D.甲+乙→丙的反应类型为取代反应
难度: 中等查看答案及解析
-
下列物质的工业制备方案合理的是
A.海带中提取碘:海带灰浸取液
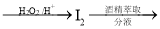 含
含 的酒精溶液
的酒精溶液 碘单质
碘单质B.由硫黄制硫酸:

C.海水制镁:
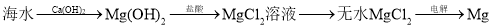
D.铝土矿制铝:
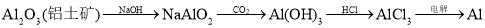
难度: 中等查看答案及解析
-
下列物质分离和提纯的方法错误的是
A.除去MgCl2溶液中的少量FeCl3

B.分离碘粉和铁粉的混合物
C.除去NaCl中的少量KNO3
D.分离砂子、鸡蛋清和葡萄糖溶液的混合物
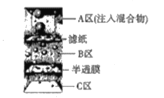
难度: 中等查看答案及解析
-
某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
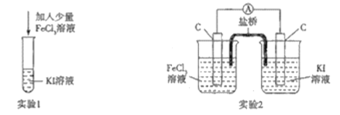
A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2
B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应
C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应
D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应
难度: 中等查看答案及解析
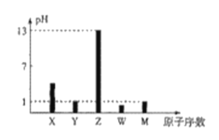
-
X、Y、Z、M、N是原子序数依次增大的五种短周期主族元索,它们能形成一种有机酸(结构如图),五种元素原子的最外层电子数之和为24,Z和N同主族,M是非金属性最强的元素,下列说法错误的是
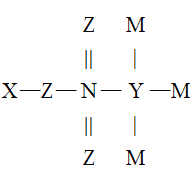
A.最高正化合价:N>Y>X
B.Z、N可分别与X形成等电子数的化合物
C.原子半径:N>Z>Y>M>X
D.Y和N均存在某种含氧酸能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
沼气是重要的生物质能,主要由有机废弃物发酵产生,其成分有CH4、CO2和H2S等,由沼气获得高纯度CH4的工作原理如图所示(交换膜左侧为酸性溶液,右侧为碱性溶液),下列说法中错误的是
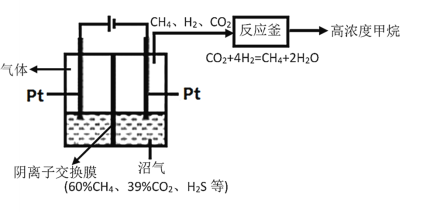
A.对沼气池进行检修时应预先通风并戴防毒面具
B.阴离子应从左侧向右侧迁移
C.在阳极上可能发生反应:HS--2e-=S↓+H+
D.一定条件下反应釜中的反应能自发进行,主要原因是该反应放热
难度: 中等查看答案及解析
-
298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
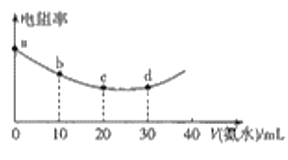
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
难度: 中等查看答案及解析
 H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1; 随时间变化的关系如图所示,
随时间变化的关系如图所示,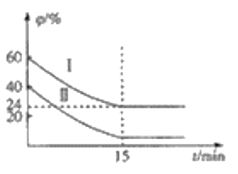
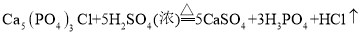 ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.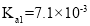 、
、 、
、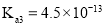 ,
,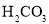 的电离常数
的电离常数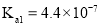 、
、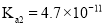 ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.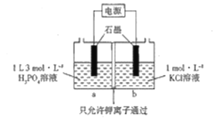
 反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物
反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物 (氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题: 和NaN3为原料在一定条件下可合成
和NaN3为原料在一定条件下可合成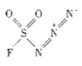 (氟磺酰基叠氮).
(氟磺酰基叠氮).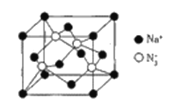
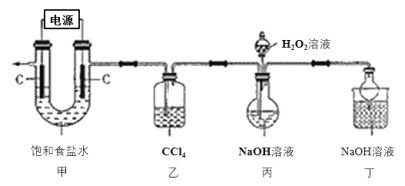
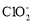 +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,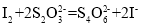 ),
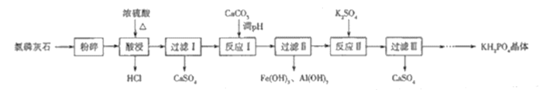
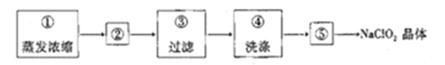
), )的原料药利伐沙班中间体,其合成路线如图:
)的原料药利伐沙班中间体,其合成路线如图: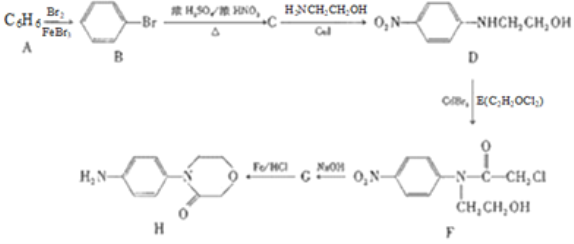
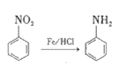
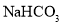 溶液反应;④
溶液反应;④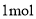 该物质与足量钠反应产生
该物质与足量钠反应产生 ;
; ,以C为原料合成
,以C为原料合成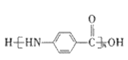 的合成路线为____________________________________________(其他试剂任选)。
的合成路线为____________________________________________(其他试剂任选)。