-
化学与人类生产、生活、社会可持续发展密切相关。下列有关说法正确的是( )
A.高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应
B.人造纤维,合成纤维和光导纤维都是有机高分子化合物
C.大量燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,从而使雨水pH=5.6形成酸雨
D.加热能杀死流感病毒是因为病毒的蛋白质受热变性
难度: 简单查看答案及解析
-
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、漂白粉、水银;②电解质:明矾、冰醋酸、石膏、纯碱;
③同位素: 1 H+、2H+、3H+;④同素异形体:C60、C80、金刚石、石墨;
⑤弱电解质:Fe(SCN)3、SO2、NH3、H2O
A.②④ B.②③④ C.②④⑤ D.全部正确
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.漂白粉长时间露置空气中会结块变质
B.把NaHSO4溶液加入NaAlO2中生成白色沉淀然后沉淀又溶解
C.装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成
D.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数,下列叙述正确的是( )
A.NaHCO3晶体中含有84 g NA个CO32-
B.常温下1LpH=13Ba(OH)2溶液中含有0.2NA个OH-
C.2.9g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.02NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
B.向NaHCO3溶液中滴加AlCl3溶液:Al3++3HCO3-=Al(OH)3↓ + 3CO2↑
C.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-= CO32-+H2O
D.SO2气体通人Ba(NO3)2溶液中:SO2+H2O+Ba2+=BaSO3↓+2H+
难度: 简单查看答案及解析
-
下列操作会导致实验结果偏高的是( )
A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量。
B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值。
C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度。
D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度。
难度: 简单查看答案及解析
-
已知NH4CuSO3与足量的1mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是( )
A.NH4CuSO3中硫元素被氧化了 B.刺激性气味的气体是二氧化硫或氨气
C.该反应中NH4CuSO3既是氧化剂又是还原剂 D.该反应中硫酸既表现为酸性又表现氧化性
难度: 简单查看答案及解析
-
对于可逆反应mA(g)十nB(g)
pC(g)十qD(g),若其它条件都不变,只是在反应前是否加入催化剂,可得到如下两种v-t图象。下列判断正确的是( )

A.b1>b2 t1>t2 B.b1<b2t1<t2
C.两图中阴影部分面积相等 D.图II中阴影部分面积更大
难度: 简单查看答案及解析
-
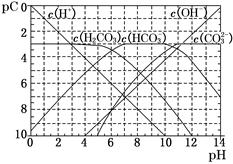
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是 ( )
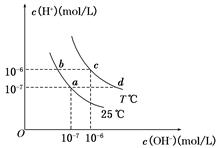
A.a点对应的溶液中大量存在:Fe3+、Na+、SCN-、
B.b点对应的溶液中大量存在:
、Ba2+、OH-、I-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、CO32-
D.d点对应的溶液中大量存在:Na+、K+、
、Cl-
难度: 简单查看答案及解析
-
下列实验方案正确且能达到相应实验预期目的的是 ( )

难度: 简单查看答案及解析
-
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
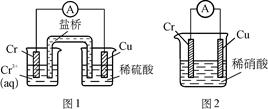
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-= Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
难度: 简单查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列对图像描述正确的是( )


A.根据图①可判断可逆反应 A2(g)+3B2(g)
2AB3(g)的ΔH>0
B.图②表示压强对可逆反应2A(g)+ B(g)
3C(g)+ D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.据图4,若除去0.1mol·L-1CuSO4溶液中的Fe3+可向溶液中加入适量NaOH至pH约为5。
难度: 简单查看答案及解析
-
海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示。判断下列说法正确的是( )
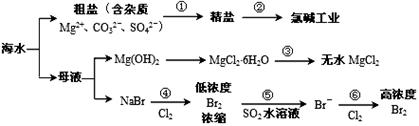
A.过程①的提纯是物理过程,氯碱工业中通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2?6H2O灼烧即可制得无水MgCl2
C.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D.在过程④、⑥反应中每氧化0.2molBr-需消耗2.24LCl2
难度: 简单查看答案及解析
-
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
⑥反应A(g)
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。
其归纳正确的是( )
A.全部 B.③④⑤⑥ C.②④⑤⑥ D.①②④⑤
难度: 简单查看答案及解析
-
下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式
CH3COOH
HClO
H2CO3
Ka
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A.等物质的量浓度的NaClO和NaHCO3 混合溶液中 c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为ClO-+CO2+H2O=CO32-+2HClO
C.25℃时,甲基橙滴入0.1mol/L的次氯酸溶液中,溶液呈红色
D.结合H+的能力:CH3COO->ClO->CO32-
难度: 简单查看答案及解析
-
炼铁的还原剂CO是由焦炭和CO2反应而得。现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:
。右图为CO2、CO的物质的量n随时间t的变化关系图。下列说法正确的是( )
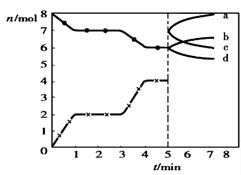
A.0~1min,v(CO)=1mol/(L·min);1~3min时,
B.当溶器内的压强不变时,反应一定达到平衡状态且
C.3min时温度由T1升高到T2,则可以判断Q>0
D.5min时再充入一定量的CO,n(CO)、n(CO2)的变化可分别由a、b曲线表示
难度: 简单查看答案及解析