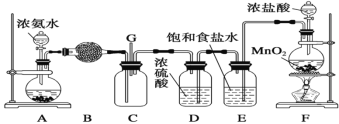
-
下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被活性炭吸附
C.酒精溶于水 D.HCl气体溶于水
难度: 简单查看答案及解析
-
下列性质中,可以证明某化合物中一定存在离子键的是
A.可溶于水 B.有较高的熔点
C.水溶液能导电 D.熔融状态能导电
难度: 简单查看答案及解析
-
下列图示过程,由太阳能直接转变为化学能的是
A.
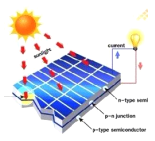 光伏发电 B.
光伏发电 B. 风力发电
风力发电C.
 水力发电 D.
水力发电 D.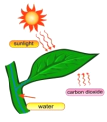 光合作用
光合作用难度: 简单查看答案及解析
-
2019年1月3日,我国“嫦娥四号”探测器成功登陆月球背面,开启了月球探测的新旅程。月球土壤中含有丰富的
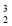 He,下列关于
He,下列关于 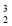 He的说法正确的是
He的说法正确的是A.原子核内含有3个质子
B.与
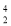 He是两种不同的核素
He是两种不同的核素C.
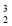 He原子核内比
He原子核内比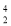 He少一个电子
He少一个电子D.
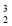 He化学性质活泼,易与O2等非金属单质反应
He化学性质活泼,易与O2等非金属单质反应难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.中子数为8的氮原子:
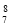 N B.H-的结构示意图:
N B.H-的结构示意图:
C.CO2的电子式:
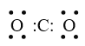 D.NaClO的电子式:Na+[Cl:
D.NaClO的电子式:Na+[Cl: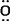 :]-
:]-难度: 简单查看答案及解析
-
热核聚变实验反应堆的原理,类似太阳发光发热,即在上亿摄氏度的超高温条件下,利用氢的同位素氘、氚的聚变反应释放出核能。下列说法正确的是
A.H、D、T互为同素异形体
B.氘、氚聚变反应生成其他元素,属于化学变化
C.H2、D2、T2在同条件下,密度之比为1∶2∶3
D.H、D、T与16O、17O、18O组成水分子的相对分子质量有18种
难度: 中等查看答案及解析
-
下列物质中,含有共价键的离子化合物是
A.Na2O B.SO2 C.MgCl2 D.Ca(OH)2
难度: 简单查看答案及解析
-
甲烷燃烧反应能提供能量是因为
A.甲烷的能量高
B.生成物分子形成化学键释放能量
C.破坏反应物分子化学键所吸收的能量小于形成生成物分子化学键所释放的能量
D.破坏反应物分子化学键所吸收的能量大于形成生成物分子化学键所释放的能量
难度: 简单查看答案及解析
-
下列反应过程中能量变化的趋势与图一致的是

A.C+CO2
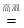 2CO
2COB.CaCO3
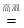 CaO+CO2↑
CaO+CO2↑C.2Al+ 6HCl=2AlCl3+ 3H2↑
D.Ba(OH)2·8H2O+ 2NH4Cl=BaCl2+ 2NH3↑+10H2O
难度: 简单查看答案及解析
-
下列关于化学键的说法正确的是
A.共价化合物中只存在共价键
B.只含共价键的物质一定是共价化合物
C.只含非金属元素的物质一定不含离子键
D.金属元素原子与非金属元素原子之间形成的一定是离子键
难度: 简单查看答案及解析
-
用稀硫酸与过量锌粒反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A.升高温度 B.滴加少量浓硫酸
C.滴加少量硫酸铜溶液 D.改用等质量的锌粉
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1.6 g CH4含有的共价键数为0.5 NA
B.2.24 L CO2中含有的分子数为0.1 NA
C.2.8 g N2和CO混合气体中的原子数为0.1 NA
D.7.8 g由Na2O2和Na2S组成的混合物中,含有的阴阳离子总数为0.3 NA
难度: 中等查看答案及解析
-
根据反应:2Ag+ + Cu = Cu2+ + 2Ag,设计如图所示原电池,下列说法错误的是( )。
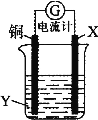
A.X可以是银或石墨
B.Y是硫酸铜溶液
C.电子从铜电极经外电路流向X电极
D.X极上的电极反应式为Ag+ + e-= Ag
难度: 中等查看答案及解析
-
下列说法正确的是
A.同周期元素中,VIIA族元素的原子半径最大
B.37号元素在元素周期表中位于第5周期IIA族
C.VIA族元素的原子,其原子半径越大,越容易得到电子
D.元素周期表中,从IIIB族到IIB族10个纵列的元素都是金属元素
难度: 中等查看答案及解析
-
短周期元素A、B可形成化合物AB2,且原子半径:B>A。下列说法正确的是
A.A肯定是金属元素 B.A、B可能在同一周期
C.A在B的前一周期 D.A可能在第3周期的ⅡA族或ⅣA族
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在周期表中的位置如图所示,X通过共用3对电子形成X2分子,下列说法不正确的是
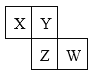
A.4种元素的简单氢化物中,Y的沸点最高
B.X、Z、W均为活泼非金属元素,其含氧酸都是强酸
C.W的单质能与水反应,生成一种具有漂白性的物质
D.化合物XW3中各原子均满足最外层8电子的稳定结构
难度: 中等查看答案及解析
-
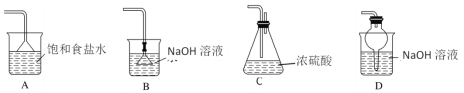
图中a、b、c表示相应仪器中加入的试剂,可用图装置制取、净化、收集的气体是
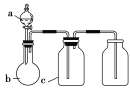
选项
气体
a
b
c
A
SO2
浓硫酸
亚硫酸钠
碱石灰
B
CO2
盐酸
碳酸钙
饱和NaHCO3
C
NO
稀HNO3
铜屑
H2O
D
NO2
浓HNO3
铜屑
NaOH溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期元素a、b、c、d、e的原子序数依次增大,由它们中的部分元素形成的化合物X、Y、Z、W在一定条件下的相互转化关系如图所示。已知X、Y、Z均含有d元素;Y是两性氢氧化物;W是一种焰色反应呈黄色的强碱;e原子的得电子能力在同周期中最强。下列说法正确的是
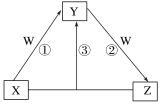
A.a、c分别与e形成的化合物的化学键类型相同
B.b元素的单质和氢化物可能具有强氧化性和漂白性
C.c的简单离子的氧化性强于d的
D.d元素的单质不能与W溶液反应
难度: 中等查看答案及解析
-
如图所示,烧杯中盛的是水,铁圈和银圈直接相连,在接头处用一根绝缘细丝吊住,并使之平衡。小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象是
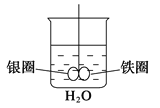
( )
A.两圈仍保持平衡
B.有气泡产生,两圈摇摆不定
C.铁圈向下倾斜
D.银圈向下倾斜
难度: 简单查看答案及解析
-
下列说法不正确的是
A.反应CaO+H2O=Ca(OH)2可放出大量的热,故可把该反应设计为原电池
B.将Fe、Cu用导线连接后放入浓硝酸中组成原电池,Cu为负极,Fe为正极
C.通过原电池装置,可将反应2H2+O2=2H2O的化学能转化为电能,为航天器供电
D.某电池反应Fe+2FeCl3=3FeCl2,当电路中有1mole-通过时,电解质溶液增重28 g
难度: 中等查看答案及解析
-
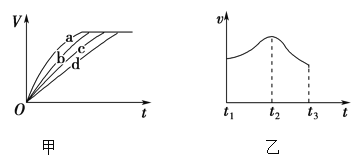
一定条件下,向某密闭容器中投入一定量的X和Y,发生反应X(g)+3Y(g)⇌2Z(g),反应过程中正、逆反应速率υ随时间t的变化情况正确的是
A.
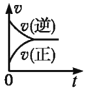 B.
B.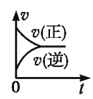 C.
C.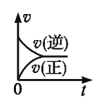 D.
D.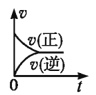
难度: 简单查看答案及解析
-
对于反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),下列措施能加快反应速率的是
①恒容条件下,再通入一定量的NH3 ②增大体系容积③恒容条件下,再通入一定量的N2 ④使用合适的催化剂
A.①②④ B.①③④ C.①④ D.②④
难度: 简单查看答案及解析
-
一定温度下,将一定量的碳粉和CO2气体置于1L的密闭容器中发生反应C(s)+CO2(g)⇌2CO(g),当下列物理量不发生变化时,能表明反应已达到平衡状态的是
①混合气体的密度 ②容器内气体的压强 ③c(CO2) ④c(CO2)∶c(CO)
A.①③ B.②④ C.①②③④ D.②③④
难度: 中等查看答案及解析
-
在一密闭容器中进行反应:2SO2(g)+O2(g)⇌2SO3(g),若SO2、O2、SO3的起始浓度分别为c1、c2、c3(均不为0),达到平衡时,SO2、O2、SO3的浓度分别为0.3 mol·L-1、0.1 mol·L-1、0.06 mol·L-1,则下列判断不正确的是
A.c1∶c2=2∶1
B.c1的取值范围为0.1<c1<0.36 mol·L-1
C.c3的取值范围为0<c3<0.26 mol·L-1
D.平衡时,SO2和SO3的生成速率之比为1∶1
难度: 中等查看答案及解析
-
一定条件下,反应N2(g)+3H2(g)⇌2NH3(g)在密闭容器中进行,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是
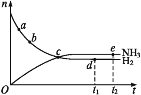
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)相同
D.该反应是放热反应,升高温度将缩短反应达到平衡的时间
难度: 中等查看答案及解析