-
生活中下列物质的有关说法错误的是
A. 食盐和白醋都可作调味剂
B. 糖类和蛋白质都可发生水解
C. 液化石油气和天然气都是含烃混合物
D. 双氧水和碘酒都可作医用消毒剂
难度: 简单查看答案及解析
-
有机物X、Y、Z的结构简式分别为
 。下列分析正确的是
。下列分析正确的是A. Y、Z互为同系物
B. Y中最多有4个C原子处于同一直线上
C. X、Z的二氯代物数目相同
D. 可用酸性KMnO4溶液一次区分X、Y、Z三种物质
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
选项
实验目的
实验操作
A
除去酯化反应后乙酸乙酯中的杂质
振荡实验后的饱和Na2CO3溶液,分液
B
验证Mg(OH)2的溶解
向盛有少量Mg(OH)2固体的试管中加入NH4Cl溶液
C
观察Fe(OH)2白色絮状沉淀生成
向含有铁粉的FeSO4溶液中加入NaOH溶液
D
检验阿司匹林片剂中含有淀粉
将浓硝酸滴到阿司匹林片上
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列判断正确的是
A. 1LpH=13的Ba(OH)2溶液中含OH-的数目为0.2NA
B. 46gCH3CH2OH含C-H键数目为6NA
C. 4.6gNa与含0.1 mol CH3COOH的稀醋酸完全反应,转移的电子数为0.1NA
D. 2.24LCH4和0.5 molCl2充分反应所得混合物中氯原子数为NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、R、Q原子序数依次增大。由这些元素组成的化合物甲、乙、丙、丁的0.1mol/L水溶液pH如下表,丙、丁为二元化合物。甲溶液逐滴滴入丙溶液中,先产生白色沉淀,后沉淀消失;乙的水溶液可除油污。下列说法一定正确的是

A. W和Q形成的化合物只含有离子键
B. Y和Z的氢化物沸点:Y<Z
C. 离子半径:r(Q>r(R)>r(Z)
D. Y和Q氧化物的水化物酸性:Q>Y
难度: 中等查看答案及解析
-
港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是
A. 防腐原理主要是避免发生反应:2Fe+O2+2H2O===2Fe(OH)2
B. 钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C. 采用外加电流的阴极保护时需外接镁、锌等作辅助阳极
D. 钢构件可采用不锈钢材料以减缓电化学腐蚀
难度: 简单查看答案及解析
-
已知:pCu=-1gc(Cu+),pX=-lgc(X-)。298K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
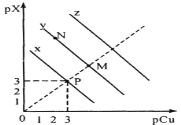
A. 298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B. 图中x代表CuI曲线,且P点c(Cu+)=c(I-)
C. 298K时增大M点的阴离子浓度,则y上的点向N点移动
D. 298K时CuBr(s)+I-(aq)
 CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
CuI(s)+Br-(aq)的平衡常数K的数量级为103或102难度: 中等查看答案及解析
 Na2S+2CO2↑
Na2S+2CO2↑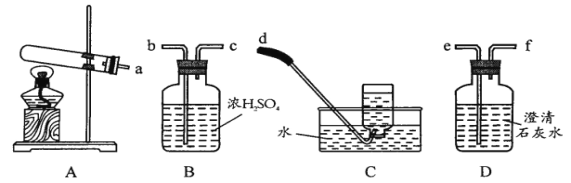

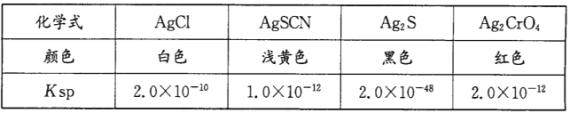
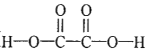 )在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。
)在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。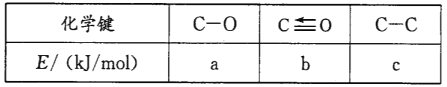
 H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。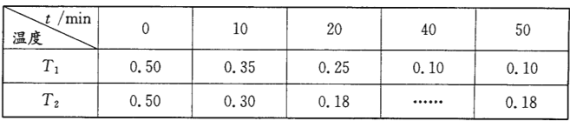
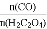 不变
不变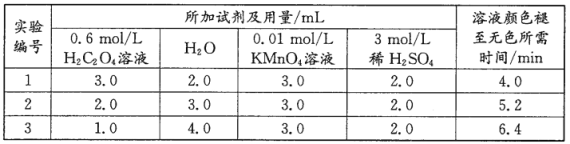
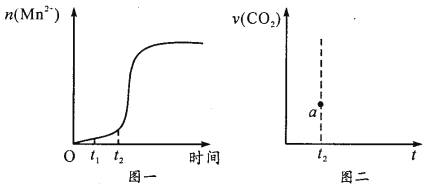 。
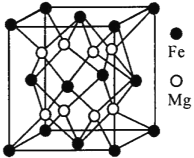
。
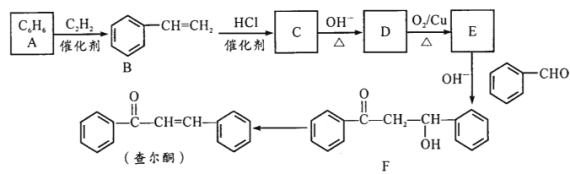
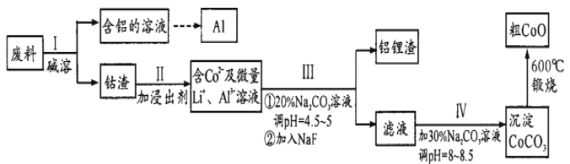
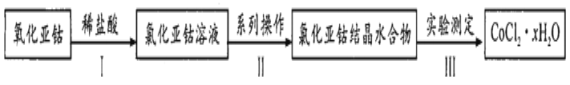
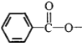 结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。
结构且水解产物为芳香醇的酯共有种_________,其中核磁共振氢谱吸收峰最少的分子结构简式为_________。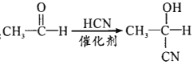 。参照上述流程,以CH2=CH-CH3为原料合成
。参照上述流程,以CH2=CH-CH3为原料合成 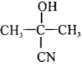 ,设计最简合成路线。_______________
,设计最简合成路线。_______________