-
同位素示踪技术已广泛应用在农业、工业、医学地质及考古等领城。下列有关叙述正确的是
A.D2O和H2O互为同位素 B.14C与12C是两种不同的核素
C.35Cl2与37Cl2互为同素异形体 D.通过化学变化可以实现18O与16O之间的相互转化
难度: 简单查看答案及解析
-
下列说法正确的是
A.中子数为9的氧原子:
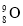
B.NH4Cl的电子式:
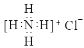
C.中子数为16,质子数为15的原子结构示意图:
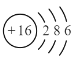
D.用电子式表示氯化氢分子的形成过程:
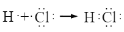
难度: 简单查看答案及解析
-
元素周期表是一座开放的“元素大厦”,”元素大厦”尚未客满。若发现120号元素,请在“元素大厦”中安排好它的“房间”
A.第七周期0族 B.第七周期第IIA族 C.第八周期第IIA族 D.第八周期第IA族
难度: 中等查看答案及解析
-
下列物质中,含有共价键的离子化合物是
A.KNO3 B.MgCl2 C.NH3·H2O D.HClO
难度: 中等查看答案及解析
-
铯是第6周期IA族元素,下列有关铯元素性质推测正确是
A.最高化合价为+2 B.原子半径比钠的小
C.单质与水的反应比钠更剧烈 D.最高价氧化物对应的水化物碱性比钠的弱
难度: 中等查看答案及解析
-
下列过程中化学键被破坏,但不属于化学变化的是
A.酒精溶于水 B.CaO溶解于水
C.KOH受热熔化 D.白磷在一定条件下转化为红磷
难度: 简单查看答案及解析
-
下列关于化学反应中能量变化的说法正确的是
A.能量变化必然伴随发生化学变化
B.在常温下可以发生的反应一定是放热反应
C.化学反应中能量变化的大小与反应物的质量多少无关
D.已知在一定温度、压强下,等质量的石墨转化为金刚石需要吸收热量,则石墨比金刚石更稳定
难度: 简单查看答案及解析
-
对下列化学反应,可设计为原电池的是
A.H2SO4+Ba(OH)2=BaSO2↓+2H2O B.NH4HCO3
 NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2OC.CaO+H2O=Ca(OH)2 D.Cu+2AgNO3=Cu(NO3)2+2Ag
难度: 中等查看答案及解析
-
某
 元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )
元素天然存在的一个原子中共有质子、中子、电子93个,其中35个粒子不带电,则该原子的相对原子质量约为( )A.58 B.64 C.35 D.30
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A.常温时,0族元素的单质都是气体
B.同周期元素中,VIIA族元素的原子半径最大
C.VIA族元素的原子,其原子半径越小,越容易得电子
D.在元素周期表中,从IIIB族到IIB族共有10个纵列且其包含的元素都是金属元素
难度: 简单查看答案及解析
-
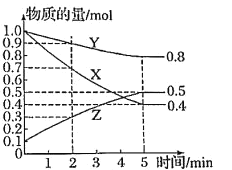
在密闭容器中发生反应:3CO(g)+Fe2O3(s)
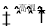 3CO2(g)+2Fe(s),下列说法正确的是
3CO2(g)+2Fe(s),下列说法正确的是A.增加Fe2O3的量反应速率加快
B.压缩容器体积,化学反应速率不一定变化
C.保持容器体积不变再充入CO反应速率加快
D.将Fe2O3固体由块状变为粉末状,反应速率不会改变
难度: 中等查看答案及解析
-
下列说法正确的是
A.12C与13C互为同素异形体
B.水泥、普通玻璃都是混合物
C.某溶液加入CCl4,充分振荡后,CCl4层显紫色,证明原溶液中存在I-
D.石英和水晶的主要成分都是二氧化硅,二氧化硅常被用来制造芯片和太阳能电池
难度: 中等查看答案及解析
-
在一定条件下,对于密闭容器中进行的反应2NO2(g)
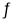 2NO(g)+O2(g),下列说法中,能充分说明该反应已经达到化学平衡状态的是
2NO(g)+O2(g),下列说法中,能充分说明该反应已经达到化学平衡状态的是A.反应混合物中NO2、NO、O2的物质的量之比为2:2:1 B.v(NO2)=2v(O2)
C.混合气体的颜色不改变 D.生成O2的速率与生成NO2的速率相等
难度: 中等查看答案及解析
-
下列有关物质性质的比较,不正确的是
A.金属性:Mg>Ca B.稳定性:H2O>H2S
C.酸性:HClO4>H2SO4 D.碱性:Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
在锌与某浓度的盐酸反应的实验中,得到如下结果:
实验序号
锌的质量/g
锌的形状
温度/℃
锌完全溶解于酸的时间/s
1
2
薄片
15
150
2
2
薄片
35
t1
3
2
粉末
35
t2
下列说法中,正确的是
①t1<t2 ②t1>150 ③实验1和实验2比较,单位时间内消耗的锌的质量前者小于后者
A.只有① B.①② C.只有③ D.②③
难度: 中等查看答案及解析
-
判断Cl的非金属性比C的强,可依据的事实是
A.HCl的热稳定性比CH4的强 B.氯气能溶于水,碳难溶于水
C.常温下,氯单质呈气态,碳单质呈固态 D.HCl的酸性比H2CO3的强
难度: 中等查看答案及解析
-
在一定条件下,将M和N两种气体通入2 L密闭容器中,发生反应如下:xM(g)+yN(g)
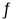 2P(g)。2s内的反应速率:v(M)=1.5 mol·L-1·s-1,v(N)=4.5 mol·L-1·s-1,v(P)=3.0 mol·L-1·s-1。则x积y的值分别为
2P(g)。2s内的反应速率:v(M)=1.5 mol·L-1·s-1,v(N)=4.5 mol·L-1·s-1,v(P)=3.0 mol·L-1·s-1。则x积y的值分别为A.2和3 B.3和2 C.3和1 D.1和3
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,X、Y具有相同的电子层数,X、Z的最低价离子分别为X2-和Z-,Y2+和Z-具有相同的电子层结构。下列说法正确的是
A.原子序数:X>Y>Z B.离子半径:X2->Y2+>Z-
C.原子最外层电子数:X>Y>Z D.Z元素的最高正价为+7价
难度: 简单查看答案及解析
-
我国空间站将在2022年前后建成,其可承载试验能力大幅提高,而且可长期连续运行。为此,需要提前造好飞船,根据空间站航天员采组更换要求和货物运输需求,按需发射。航天飞船可用腓(N2H4)做动力源,已知:1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为:N2H4+2H2O2=N2↑+4H2O。下列说法中正确的是
A.该反应中过氧化氢做还原剂
B.肼(N2H4)分子中只存在极性共价键
C.该反应的反应物总能量高于生成物的总能量
D.该反应过程中断开旧化学键吸收的能量大于形成新化学键释放的能量
难度: 中等查看答案及解析
-
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法错误的是
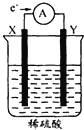
A.溶液中的
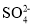 移向电极Y
移向电极YB.若两电极分别为铁棒和碳棒,则X为铁棒且X为原电池的负极
C.X极上发生的是氧化反应,Y极上发生的还原是反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
难度: 中等查看答案及解析
 N2+2CO2。
N2+2CO2。