-
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种核素应表示为( )
A.34He B.23He C.24He D.33He
难度: 简单查看答案及解析
-
信息、材料和能源被称为新科技革命的三大支柱。下列有关说法错误的是( )
A.复合材料保持了原材料的优点,又有优于原材料的特点
B.玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁
C.“神六”飞船使用了大量的复合材料
D.铜是一种有色金属材料
难度: 中等查看答案及解析
-
镁铝合金因坚硬、轻巧、美观、洁净、易于加工,而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好 C.密度小 D.强度高
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.二氧化硅是制造光导纤维的材料, 单质硅是良好的半导体材料
B.SiO2和CO2都是酸性氧化物,但SiO2不能和水反应生成硅酸
C.保存NaOH溶液时不能用玻璃塞
D.二氧化硅性质稳定,不与任何酸反应
难度: 简单查看答案及解析
-
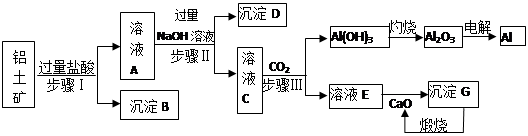
向甲溶液中加入(或通入)乙溶液(或气体),生成的沉淀的量与加入的乙的量的关系符合右图的是( )
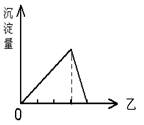
选项 A B C D
甲 Al2(SO4)3 Na[Al(OH)4] AlCl3 Ca(OH)2
乙 NH3 HCl NaOH CO2
难度: 简单查看答案及解析
-
下列各组物质均属于硅酸盐制品的是( )
A.陶瓷、水泥 B.单晶硅、玻璃
C.石膏、漂白粉 D.水玻璃、铝热剂
难度: 简单查看答案及解析
-
能实现下列物质间直接转化的元素是( )
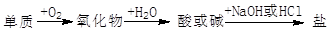
A.铝 B.铜 C.硅 D.硫
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.同种元素的质子数必定相同
B.质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
C.原子核都是由质子和中子构成的
D.电子数相同的粒子不一定是同一种元素
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.R2+离子核外有a个电子,b个中子,R原子表示为:
R
C.碱金属元素是指ⅠA族的所有的元素
D.除短周期外,其它周期均为18种元素
难度: 简单查看答案及解析
-
下列各组指定原子序数的元素,不能形成AB2型化合物的是( )
A.6和8 B.16和8 C. 12和9 D. 11和6
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的位置如图所示。下列说法中正确的是( )
A.W的最高价氧化物对应的水化物是强酸
B.Y的原子半径在同周期主族元素中最大
C.W的非金属性比Z的弱
D.Z的气态氢化物的稳定性在同主族元素中最强
难度: 简单查看答案及解析
-
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>H2O>PH3
难度: 简单查看答案及解析
-
日本福岛第一核电站发生严重的核辐射泄漏,日本政府向核电站附近居民发放碘片(127I),以降低放射性碘对人体的伤害。已知放射性碘(131I)的核电荷数为 53,则下列说法正确的是( )
A.127I与131I互为同素异形体 B. 131I和131Xe互为同位素
C.131I 原子的中子数为78 D.127I 原子和131I 原子的相对原子质量相同
难度: 简单查看答案及解析
-
设NA代表阿佛加德罗常数,下列说法正确的是( )
A.1mol SiO2和22.4L CO2的所含的氧原子数相等
B.18g D2O(重水)中含10NA个中子
C.0.1molNH4+所含有的电子数为NA
D.35g35Cl2气体的体积约为22.4L
难度: 中等查看答案及解析
-
今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍。A和B分别是( )
A.碳原子和铝原子 B.硼原子和氦原子
C.氯原子和碳原子 D.硅原子和钠原子
难度: 简单查看答案及解析
-
下列离子方程式中书写正确的是( )
A.氧化铝与NaOH溶液反应:Al2O3+10OH - = 2[Al(OH)4] - +H2↑
B.水玻璃中加入稀盐酸:Na2SiO3+2H+ =H2SiO3↓+2Na+
C.Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
D.氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O="==" Al(OH)3 ↓+3NH4+
难度: 困难查看答案及解析
-
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.原子半径:X>Y>W>Z B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X D.离子半径:X+>Y2+>W2->Z-
难度: 简单查看答案及解析
-
下述实验能达到预期目的的是( )
编号 实验内容 实验目的
A 将Na2CO3和NaHCO3 的固体混合物加热灼烧 除去NaHCO3中的Na2CO3
B 常温时将CO通过装有SiO2 的硬质玻璃管 制取粗硅
C 向新制得的K2S溶液中滴加新制的氯水 比较氯与硫的得电子能力
D 分别向2支盛有冷水的试管中加入相同大小的镁条和铝条。 比较镁铝的金属性强弱
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是( )
①无色溶液中:K+、Na+、Cu2+、SO42-
②使酚酞溶液变红的溶液中:CO32-、Na+、[Al(OH)4] -、NO3--
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、Na+
④无色透明溶液中:SiO32-、Na+、Cl-、OH-
A.①② B.③④ C.②④ D.①④
难度: 简单查看答案及解析
-
向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和Na[Al(OH)4]的澄清溶液,则加入金属钠的质量是( )
A.3.45 g B.2.3 g C.1.15 g D.0.575 g
难度: 简单查看答案及解析