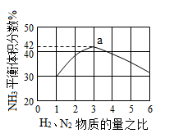
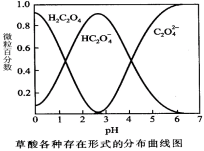
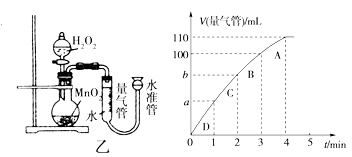
-
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是
A.太阳能 B.核能 C.氢能 D.电力
难度: 简单查看答案及解析
-
下列物质:①盐酸 ②食盐水 ③熔化的氯化钠 ④液态氯化氢 ⑤铜 ⑥氨水 ⑦SO3 ⑧醋酸,其中可以导电并且属于强电解质的是
A.只有③ B.①②③⑥⑧ C.④⑤ D.全部都是
难度: 中等查看答案及解析
-
已知某化学反应A2 (g)+2B2 (g)===2AB 2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是

A.该反应的进行一定需要加热
B.该反应的ΔH=-(E1-E2)kJ/mol
C.该反应中反应物的键能总和大于生成物的键能总和
D.断裂1 mol A—A键和2 mol B—B 键放出E1 kJ能量
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
B.CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
C.一定温度下,反应MgCl2(l)===Mg(l)+Cl2(g)的ΔH>0,ΔS>0
D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
难度: 中等查看答案及解析
-
对于制氢气原理CH4(g)+H2O(g)
CO(g)+3H2(g)ΔH=+206.4 kJ·mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是
A.降低压强 B.增大水蒸气浓度 C.加入催化剂 D.升高温度
难度: 中等查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
(i) I2(g)+ H2(g)
2HI(g);△H=-9.48 kJ·mol-1
(ii)I2(S)+ H2(g)
2HI(g);△H=+26.48 kJ·mol-1下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.反应(i)的产物比反应(ii)的产物稳定
C.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
难度: 中等查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g)ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是( )

A.t1时增大了压强 B.t2时充入了稀有气体
C.t3时升高了温度 D.t4时降低了温度
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O≒H++OH﹣△H>0,下列叙述正确的是
A.向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH﹣)增大
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,c(H+)不变
难度: 中等查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1 2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1 H—H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为
A.-118 B.+130 C.-332 D.+350
难度: 中等查看答案及解析
-
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1+ΔH3=ΔH2
C.ΔH1<ΔH3 D.ΔH1+ΔH2>ΔH3
难度: 中等查看答案及解析
-
已知次氯酸是比碳酸还弱的酸,反应Cl2+H2O
HCl+HClO达到平衡后,要使HClO浓度增大,可加入
A.NaHSO3固体 B.水 C.CaCO3固体 D.NaOH固体
难度: 中等查看答案及解析
-
将BaO2放入密闭的真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.O2浓度增加 C.O2压强不变 D.BaO量不变
难度: 中等查看答案及解析
-
在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g)
CH3OH(g)ΔH<0。第2 min时只改变一个条件,反应情况如下表:
时间
c(CO)/mol/L
c(H2)/mol/L
c(CH3OH)/mol/L
起始
1
3
0
第2 min
0.8
2.6
0.2
第4 min
0.4
1.8
0.6
第6 min
0.4
1.8
0.6
下列说法不正确的是
A.第4 min至第6 min该化学反应处于平衡状态
B.第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C.第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D.第6 min时,其他条件不变,如果升高温度,正反应速率增大
难度: 中等查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量和容器Ⅱ中的一样多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
难度: 困难查看答案及解析
-
汽车尾气中,产生NO的反应为:N2(g)+O2(g)
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是:
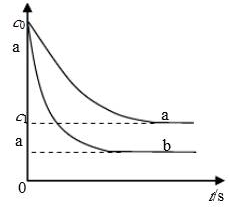
A.曲线b对应的条件改变可能是加入了催化剂
B.温度T下,随着反应的进行,混合气体的密度减小
C.温度T下,该反应的平衡常数K=
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
难度: 困难查看答案及解析
-
如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是

A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
难度: 困难查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动
B.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
C.650℃时,反应达平衡后CO2的转化率为25.0%
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 困难查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2+3H2
2NH3 △H=-92.4kJ/mol)下列说法正确的是
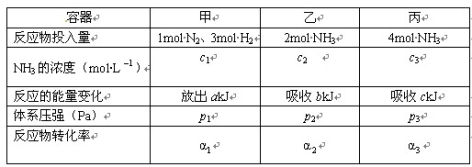
A.2c1>c3 B.a1+a3<1 C.2p2<p3 D.a=b
难度: 中等查看答案及解析